摘要
表皮调节素(EREG)作为表皮生长因子(EGF)蛋白超家族成员之一,已被证实在多种肿瘤中的表达增加,在其发生、增殖、迁移与侵袭、耐药中发挥重要作用。EREG作为EGF家族的配体,可与相应的受体结合激活下游信号通路(如 RAS/RAF/MEK、JAK/STAT3和 PI3K/AKT通路),调节肿瘤的生物学行为。本文综合分析了 EREG 在常见肿瘤中的作用、机制及其在肿瘤微环境中的作用,以期为研究其在肿瘤的发生和治疗耐药中的作用,寻找新型分子靶点提供参考。
Abstract
Epiregulin (EREG), a member of the epidermal growth factor (EGF) protein superfamily, has been confirmed to have increased expression in various types of cancer and plays a significant role in the occurrence, proliferation, migration, invasion, and drug resistance of tumors. Research indicates that EREG, as a ligand of the EGF family, can bind to corresponding receptors to activate downstream signaling pathways, such as the RAS/RAF/MEK, JAK/STAT3, and PI3K/AKT pathways, thereby regulating the biological behavior of tumors. Additionally, the role of EREG in the tumor microenvironment has been elucidated. This provides new directions for studying its role in the occurrence and therapeutic resistance of cancer. This article comprehensively analyzes the role and mechanism of EREG in common cancers, providing a reference and theoretical basis for the subsequent search for novel molecular targets.
Keywords
肿瘤作为全球第二大致死原因,已成为世界公共卫生面临的重大威胁。据最新GLOBOCAN全球癌症统计数据显示,乳腺癌、肺癌、结直肠癌、前列腺癌、胃癌等是男性和女性中最常见的恶性肿瘤类型。其中,肺癌是最常见的诊断癌症之一,也是癌症死亡的主要病因。在男性中,肺癌发病率(15.3%)和死亡率(22.7%)占所有恶性肿瘤的第一位。在女性中,肺癌发病率(9.4%)和死亡率(13.6%)仅次于乳腺癌 (15%)位居第二位[1]。在中国,肺癌也是最主要的癌症类型和首要的癌症死亡原因[2]。近年来针对肿瘤患者的治疗方法已经取得了显著进展,包括手术、放疗、化疗、免疫疗法和靶向治疗等,但绝大多数患者被发现时已处于中晚期,已错过最佳的治疗时机,肿瘤的耐药性和高复发率仍是亟待解决的问题。本文旨在综合分析目前肿瘤标志物和治疗靶点的相关研究进展,尤其关注在肿瘤发展中起重要作用的分子,如表皮调节素(EREG)。通过深入探讨 EREG 在肿瘤生物学中的作用及其作为潜在治疗靶点的可能性,为未来开发新的肿瘤治疗策略提供新的切入点,从而提高患者的生存率以及改善预后。
1 EREG概述
EREG 最初是由 Toyoda 等[3] 在 1995 年从小鼠成纤维细胞来源的肿瘤细胞系 NIH3T3/T7 的条件培养上清中发现并纯化的,是表皮生长因子 (epidermal growth factor,EGF)蛋白超家族成员之一。它是由46个氨基酸组成的一条单链多肽,分子量约为 5 400 Da,其氨基酸序列和 EGF 家族其他成员氨基酸序列具有 24%~50% 的一致性。由于其 46 位点携带的亮氨酸是用于有丝分裂和与受体结合的关键残基,从而显示出比其他EGF成员更强的生物活性,更能有效地刺激细胞增殖和 DNA 合成,同时还发现EREG能够刺激上皮细胞和成纤维细胞的生长。
人 EREG 基因位于染色体 4q13.3,与编码 EGF 家族的双调节素和 β细胞素的基因相邻。EREG 蛋白 cDNA最初表达为由 162个氨基酸组成的跨膜形式,其成熟的可溶性形式包含在前体的胞外区域,然后再被整合素和金属蛋白酶切割,并释放出约50个氨基酸组成的成熟形式。成熟的 EREG 与表皮生长因子受体 ErbB 家族成员结合,可相应的激活相关信号通路,最终诱导一系列的细胞信号级联反应[4]。正常生理状态下,EREG 具有参与生理应激、细胞增殖和再生、炎症反应、伤口愈合、卵母细胞成熟、血管生成调节等功能[5]。但异常表达的 EREG 会促进许多不同恶性肿瘤的进展,高表达 EREG 的患者通常预后较差,并通过激活 EGFR 信号通路促使肿瘤细胞致癌转化,导致总生存率降低。这提示 EREG 在恶性肿瘤进展和治疗抵抗中具有重要作用。
EGF家族包括以下几种已知配体:EGF、转化生长因子-α(Transforming growth factor alpha,TGF-α)、肝素结合样表皮生长因子(Heparin-binding epidermal growth factor,HB-EGF)、双调节素(Amphiregulin, AREG)、β 细胞素(Betacellulin,BTC)、表皮调节素 (EREG)和上皮细胞有丝分裂原(Epigen,EPGN)[6]。这些 EGF 家族成员前体的结构特征基本都含有 N-末端信号肽、前肽区、表皮生长因子样结构域、疏水性跨膜结构域和细胞质结构域,并且编码的蛋白质是受体酪氨酸激酶 ErbB 家族的配体[7]。当这些配体与相应受体结合后,形成受体同源或异源二聚体,随后通过细胞内结构域的磷酸化诱导ErbB信号传导,使得细胞内 RAS/RAF/MEK、JAK/STAT3 和 PI3K/AKT 等信号通路被激活,从而介导肿瘤细胞生长、增殖、迁移和侵袭以及细胞凋亡[8-9]。EREG主要与 EGF 受体 EGFR 和 ErbB4 特异性结合,刺激 EGFR 和 ErbB4 酪氨酸磷酸化,通过下游信号传导以调节肿瘤细胞的增殖和抗凋亡,从而使肿瘤细胞增殖更快速,侵袭性更强[10-11],见图1。
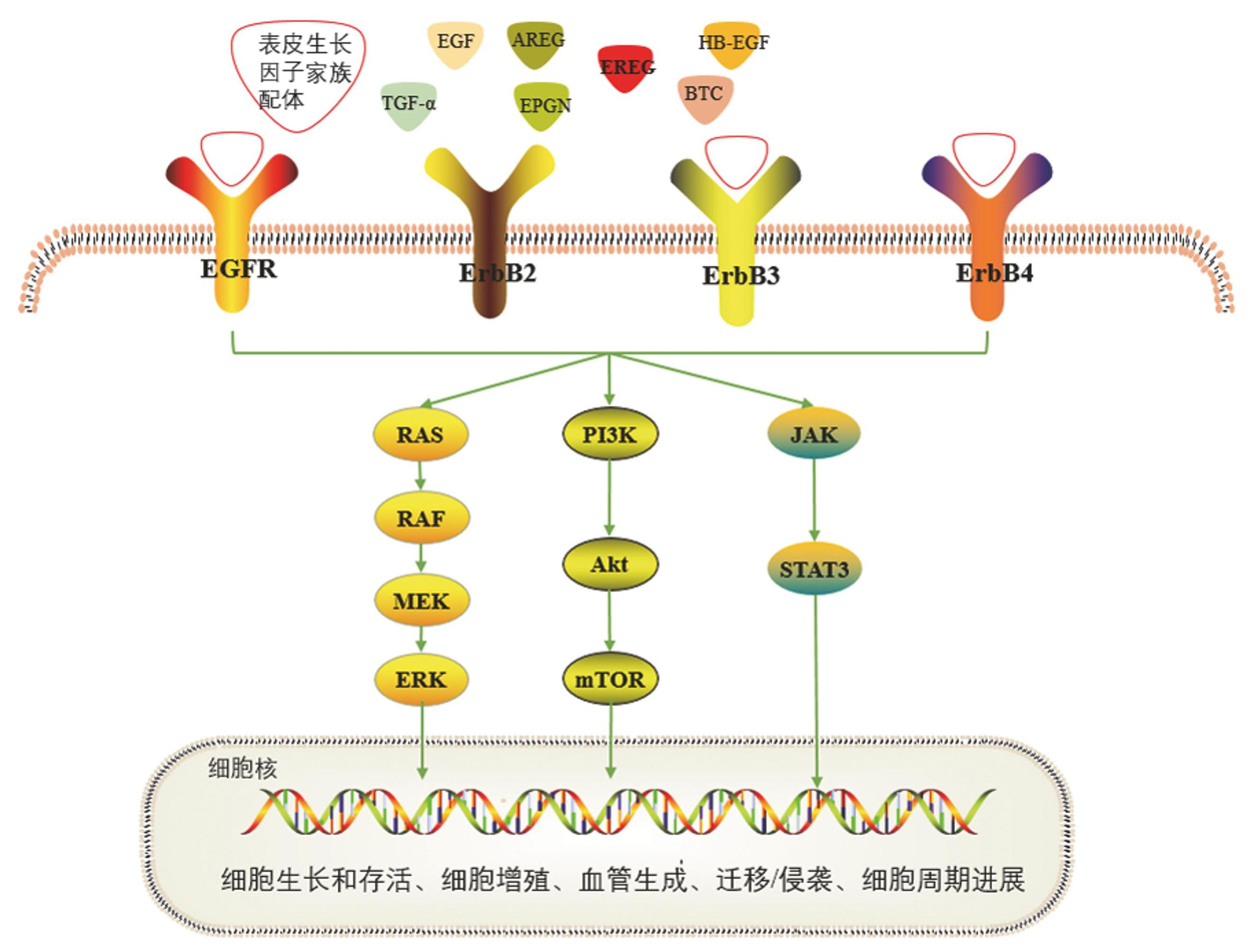
图1表皮生长因子家族配体与激活的信号通路
2 EREG与肿瘤
研究发现EREG在健康人群的组织中表达量相对较低,主要表达在正常组织的胎盘和外周血巨噬细胞上,但在多种人类肿瘤中表达量升高,尤其在上皮肿瘤细胞系中表达量最高[12]。自EREG被发现以来,已经在多种类型的癌症中证实 EREG 表达上调或活性增加能够促进肿瘤进展,包括乳腺癌、膀胱癌、胃癌、结直肠癌、胆囊癌、肺癌、肾癌、恶性神经胶质瘤、头颈癌[4-5,13]。
2.1 促进肿瘤发生
高表达的EREG介导肿瘤发生已经在一些研究中得以验证。Farooqui等[14] 在探究 EREG 对乳腺癌形成早期阶段的影响中发现,与未转化的乳腺上皮比,乳腺导管原位癌的 EREG 水平增加,且增加的 EREG能通过调节未转化乳腺上皮细胞和基质金属蛋白酶-1 的表达促进乳腺癌的发生。Nakamura 等[15] 研究发现 E74 样 ETS 转录因子 3(E74-like ETS transcription factor 3,ELF3)通过下调 EREG/EGFR/ mTORC1 信号通路抑制胆囊癌的发展。ELF3 作为胆囊癌的肿瘤抑制因子,在胆囊癌组织中经常观察到功能丧失突变。该研究表明 ELF3 能直接调控 EREG,而 EREG 的缺失会导致 EGFR/mTORC1 下调,意味着EREG对胆囊癌的发生有促进作用。Xia 等[16] 研究发现,EREG 在胃癌组织中的表达高于癌旁组织。他们认为即使有很多其他原因导致胃癌进展,但 EGFR 及其配体 EREG 的异常表达是胃癌形成和进展的主要原因。有研究表明暴露于一些化学致癌物会诱导 EREG 的表达升高从而促进肺癌进展。Chen 等[17] 研究结果显示,3-硝基苯并蒽 (3-Nitrobenzanthrone,3-NBA)是空气中的一种潜在致癌物,暴露于其中会导致肺癌细胞中 EREG 的表达量增加并促进支气管上皮细胞的恶性转化。这其中的机制可能是由于 EREG 在 3-NBA 转化细胞中的过表达显著激活了 PI3K/AKT、MEK/ERK信号通路。此外,升高的EREG还能激活IL-6的表达,两者通过 STAT3 途径协同促进肺癌细胞的存活和迁移。该团队研究结果证明了EREG在暴露于各种化学致癌物后表达量会显著增加,在肺癌的发展过程中发挥关键作用。
2.2 促进肿瘤增殖
EREG 能促进肿瘤细胞的增殖能力。Morato 等[18] 研究发现,外部和内部激活的 EGFR 信号能够驱动乳腺上皮细胞的增殖。他们在经过实验验证后认为,当消除外部生长因子刺激时,乳腺上皮细胞系仍然能够依赖 EGFR 信号通路来维持活跃状态,可能是由于细胞内部产生的包括 EREG 在内的 3 种 EGFR 配体所介导的 EGFR 激活信号决定的。这一研究结果也说明EREG在乳腺细胞中表达水平较高,其所介导的自分泌信号转导能够维持乳腺上皮细胞的增殖和存活。Li 等[13] 研究发现,EREG 在宫颈癌晚期细胞中也呈现出高表达。通过转染 siRNA 敲低宫颈癌细胞系中的 EREG,并用 CCK-8 来测定细胞的增殖情况,结果表明 EREG 会破坏宫颈癌细胞的增殖并促进细胞凋亡。这说明EREG是宫颈癌进展的驱动因素,未来可以作为靶向治疗的潜在靶点。Kumbrink 等[19] 在研究结直肠癌的预后因素时阐明,p130Crk 相关底物(p130Cas)与 EREG 表达呈负相关,并且 p130Cas 通过限制 EREG 的表达来抑制结直肠癌细胞的增殖。而在结肠癌细胞系中敲除 p130Cas 会使 EREG 表达升高,高表达的 EREG进一步促进结直肠癌细胞的增殖。因此可以考虑过表达 p130Cas 来抑制 EREG 的表达,从而使结直肠癌细胞增殖受到抑制,这有可能作为治疗结直肠癌的一种新策略。
2.3 促进肿瘤迁移、侵袭
EREG在各种类型癌症中的异常表达不仅促进肿瘤细胞的增殖,还促进肿瘤细胞的迁移和侵袭。 Li 等[20] 在探究微肽 MIAC 与肾癌的关系时发现,由长链非编码 RNA(long-non-coding RNA,lncRNA) 编码的微肽MIAC在肾癌进展中具有抑癌潜力。其主要机制是过表达的 MIAC 通过与 AQP2 蛋白结合,抑制了EREG/EGFR相关信号通路PI3K/AKT和 MAPK 的激活,从而抑制肾癌细胞的迁移能力,促进肾癌细胞的凋亡。这表明了EREG在肾癌细胞的迁移和侵袭中发挥重要作用。Chen等[21] 研究表明,肿瘤相关单核细胞通过神经胶质瘤中的EGFR信号转导促进间充质转化。该研究发现当单核细胞浸润到野生型的胶质母细胞瘤后就会转变为表达 EREG/AREG的肿瘤相关单核细胞,而这两种EGFR 配体的过表达与间充质亚型相关。FOSL2 作为肿瘤相关单核细胞的主要调节因子也同样能够调节 EREG/AREG 的表达,并证明了 FOSL2-EREG/ AREG-EGFR 轴在体外能够促进神经胶质瘤的侵袭。Wang等[22] 发现,EREG是肿瘤相关成纤维细胞 (cancer-associated fibroblasts,CAFs)中最显著上调的基因,CAFs中EREG的高表达与口腔鳞状细胞癌患者较高的侵袭性和较差的预后相关,EREG 通过 JAK2-STAT3通路诱导CAFs激活,并能促进口腔鳞状细胞癌迁移和侵袭所必需的上皮-间质转化 (Epithelial-mesenchymal transition,EMT)。由此可见,各类肿瘤中高表达的 EREG 通过激活 EGFR 受体使下游信号通路活化,赋予肿瘤细胞更高的迁移和侵袭能力。
2.4 促进肿瘤耐药
EREG导致的获得性耐药是肿瘤患者从化疗中获益的主要障碍。Chen 等[23] 研究发现,EREG 会导致结肠癌患者对 5-氟尿嘧啶(5-fluorouracil,5-FU) 获得性耐药。该研究表明硫化氢(H2S)能促进肿瘤周围血管生成和结肠癌细胞的增殖与迁移,通过下调结肠癌细胞中的 miR-215-5p 诱导胸苷酸合成酶 (thymidylate synthase,TYMS)和 EREG 的表达,这可能是结肠癌细胞对5-Fu获得性耐药的机制,可以通过调节 miR-215-5p/EREG/TYMS 轴抑制 H2S 合成来逆转对 5-FU 的获得性耐药,显著增加结肠癌细胞系对 5-FU 敏感。Jehl 等[24] 研究表明,EREG 在头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)中的过表达与患者较短的生存期相关。在不同 HNSCC 细胞系中沉默 EREG 可以发现,EREG的缺失通过诱导铁死亡使HNSCC对西妥昔单抗治疗敏感。He等[25] 发现,乳腺癌中高表达的EREG通过EGFR信号诱导Warburg效应,增加葡萄糖转运蛋白 3、己糖激酶 2和丙酮酸脱氢酶激酶 1 等糖酵解基因的表达,从而增加乳腺癌细胞对他莫昔芬的耐药。该研究还表明,miR-186-3p/EREG 轴是调节肿瘤细胞对他莫昔芬耐药性和有氧糖酵解的关键调节途径,而有氧糖酵解已被证实与肿瘤耐药密切相关。Zhang 等[26] 利用 TCGA 数据库进行 GO 富集分析,筛选出包括 EREG 在内的 32 个耐药基因。发现 EREG 通过 ERK 信号通路能增加干细胞相关基因的表达,并促进癌症干细胞对化疗药的抵抗。而对 EREG/ErbB 的抑制能够下调 ERK 信号,导致干细胞相关基因的表达减少,逆转 NSCLC 细胞的耐药。综上所述,EREG 在肿瘤的耐药性中发挥重要作用。
3 EREG与肿瘤诊断和治疗
3.1 EREG与肿瘤诊断
多数情况下肿瘤患者直到病情进展的中晚期才被确诊,这意味着他们无法在早期得到有效治疗,因此寻找肿瘤早期诊断标志物对于提高患者生存率和改善预后显得尤为重要。Xia等[27] 发现胃癌组织中的EREG表达水平明显高于邻近非癌组织和低级别上皮内瘤变,并且 EREG 的表达水平与肿瘤恶性生物学特性、胃癌的 TNM 分期(包括原发癌肿瘤的大小、淋巴结转移、远处转移)及总生存期相关。高表达的EREG与TNM分期正相关,这说明随着患者病程加重,EREG 的表达水平也越来越高。因此可以将 EREG 作为胃癌早期的诊断标志物。 Cai等[28] 在比较肝癌患者和健康人群血清和肝脏中 EREG 的表达水平后发现,肝细胞癌患者的 EREG 水平显著高于健康人。因此可以考虑将EREG水平作为一种有效的生物标志物,辅助肝癌的早期诊断。但需要注意的是,在肝癌细胞系 HepG2 和 HUH7中敲低 EREG,却能够促进细胞增殖和迁移、加速细胞周期、抑制细胞凋亡,表现出完全相反的肿瘤生物学特性。猜测导致这种现象的原因可能是在体外的细胞培养条件下难以完全模拟肿瘤微环境中各种因素间复杂的相互作用,也有可能是由于EREG功能的多样性使得其在不同肿瘤细胞类型中发挥不同的作用。
3.2 EREG与肿瘤治疗
Liu 等[29] 在对 HNSCC 的研究中发现,EREG 作为一种癌基因在 HNSCC 中的表达显著上调,通过激活 EGFR 下游的 ERK 信号通路诱导潜在靶基因 c-Myc 的表达从而促进 HNSCC 的发生。并且高表达的EREG预示着患者不良预后。同时他们发现高表达的EREG与EGFR抑制剂厄洛替尼的治疗效果呈正相关。这表明EREG的表达可以作为肿瘤治疗预测的生物标志物。还有研究发现,在 KRAS 突变的NSCLC细胞中EREG呈现高表达状态,并确定了 EREG 是 KRAS 突变的 NSCLC 细胞中致癌 KRAS 信号转导的转录靶点[30]。当siRNA介导的EREG敲低后能够抑制 KRAS 突变的 NSCLC 细胞的生长并诱导凋亡。这表明靶向 EREG 可以作为治疗 NSCLC 的一种选择。尽管表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptorstyrosine kinase inhibitors,EGFR-TKIs)等化疗药物对 NSCLC治疗有效,但最终都会引起获得性耐药,这也正是晚期 NSCLC 患者治疗失败和死亡的主要原因。Ma 等[31] 研究发现,EREG 通过依赖 ErbB2 的方式诱导 EGFR/ErbB2 异二聚体的形成,激活下游 PI3K/AKT信号通路从而阻止EGFR-TKIs诱导的细胞凋亡,降低细胞对 EGFR-TKIs 的敏感性。因此,靶向EREG能够有效地解决化疗药耐药性的问题。
肿瘤微环境(tumor microenvironment,TME)作为一个复杂的生态系统在肿瘤进展中起着决定性作用,靶向TME可以作为癌症的治疗靶点。由于癌细胞基因组的不稳定性容易产生耐药,靶向TME比直接靶向癌细胞更能提高患者的治疗效果[32]。 Wang等[33] 发现在治疗受损的TME中将特异性靶向 EREG作为一种联合治疗可以显著提高癌症治疗效果。肿瘤患者在经过放疗或化疗后会诱导细胞衰老,但也会不可避免地影响到周围基质细胞逐渐衰老,通过释放衰老相关分泌表型影响 TME,而受损的 TME 会赋予肿瘤治疗耐药性。EREG 正是衰老相关分泌表型中上调水平最高的成分之一,在受损的基质细胞中显著表达。该团队基于动物模型发现特异性消除 EREG 能够增强肿瘤对治疗的反应,并且这种治疗策略可以广泛应用于不同恶性肿瘤。研究表明 EREG 主要在 TME 中的 CAFs 和肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)中表达[31],来源于肿瘤细胞的 EREG 不影响 EGFR-TKI的敏感性,而是由TAMs产生的EREG诱导肺癌细胞对 EGFR-TKIs 产生耐药。因此,靶向 TAMs中的 EREG 能够为癌症的诊断和治疗提供新的思路。近几年在有关癌症治疗的研究[34-35] 中,通过靶向TAMs以抑制肿瘤进展受到众多国内外学者的关注。而进一步了解EREG在肿瘤浸润免疫细胞或癌细胞中表达的特定作用,可以优化针对不同癌症类型的靶向治疗。
4 小结与展望
肺癌是全球最常见的诊断癌症和癌症死亡的主要原因。许多研究表明EREG的异常表达与非小细胞肺癌等多种肿瘤的发生发展密切相关,能通过激活 EGFR 相关信号通路参与肿瘤细胞的增殖、迁移、侵袭和耐药等生物学过程。肿瘤患者对化疗药物的耐药是导致高死亡率和较差预后的主要原因,因此急需探究早期诊断的生物标志物和针对耐药机制的治疗靶点来逆转耐药,从而提高肿瘤患者的生存率和改善预后。
近年来,针对 TME 的治疗受到广泛关注,而 TME中的一些成分会影响肿瘤患者对放化疗、靶向治疗和免疫治疗的敏感性。已证实EREG介导的肿瘤进展是由TME中的肿瘤细胞、成纤维细胞和肿瘤相关巨噬细胞的自分泌或旁分泌环产生的,其中由肿瘤相关巨噬细胞释放的 EREG 可以作为 EGFRTKIs 治疗 NSCLC 的一个新的靶点。因此,针对 EGFR-TKIs 耐药的 NSCLC 患者可以考虑从减少 TAMs募集和TAMs耗竭这一角度的治疗策略入手。但TME是一个复杂的动态网络,仅仅靶向其中某一细胞成分的单一疗法并不能有效改善肿瘤患者对治疗的反应,还需要对这些成分进一步的研究分析,将TME靶向治疗与其他疗法联合起来以提高患者的治疗效果。同时,EREG 作为治疗靶点还需要大量的临床试验来验证其安全性和有效性,未来在深入探究 EREG 的作用机制后,或许能通过开发更多 EREG 特异性抑制剂来用于肿瘤的治疗,为肿瘤患者的治疗和预后提供新策略和思路。
