摘要
糖尿病性心肌病(DCM)是糖尿病患者持续性高血糖、高胰岛素血症导致的严重心血管并发症之一,死亡率高。沉默信息调节因子3(SIRT3)是一种烟酰胺腺嘌呤二核苷酸(NAD +)依赖性脱乙酰酶蛋白,通过多种信号通路参与调节氧化应激、线粒体功能、细胞凋亡等病理生理过程,在 DCM 中发挥保护作用。该文阐述了 SIRT3 在DCM中,特别是心脏线粒体代谢和功能调节中的研究进展。
Abstract
Diabetic cardiomyopathy (DCM) is a severe cardiovascular complication resulting from persistent hyperglycemia and hyperinsulinemia in diabetic patients, showing a high mortality rate. Sirtuin 3 (SIRT3) is a nicotinamide adenine dinucleotide (NAD + ) -dependent deacetylase that participates in various signaling pathways to regulate oxidative stress, mitochondrial function, apoptosis, and other pathophysiological processes, thereby exerting a protective effect in DCM. This review provides an overview of the latest research progress on SIRT3, focusing particularly on its involvement in regulating cardiac mitochondrial metabolism and function in the context of DCM.
Keywords
糖尿病(DM)是一种以胰岛素分泌不足或存在胰岛素抵抗,导致高血糖和糖化血红蛋白水平升高为特征的代谢紊乱性疾病[1-2]。糖尿病性心肌病 (DCM)是DM患者严重的心血管并发症之一,严重损害患者生活质量,并因血糖控制恶化而导致残疾和过早死亡[3]。因此,控制 DCM 的发生对 DM 的治疗至关重要。然而,目前 DCM 的治疗主要集中在控制血糖和血脂上,缺乏针对受损心肌组织的有效药物或策略,其主要原因在于 DCM 发生的分子病理机制仍未完全阐明。心脏线粒体丰富,负责提供高三磷酸腺苷(ATP)以维持心肌收缩和舒张功能。目前大量的文献描述了线粒体功能障碍是 DCM 的重要特征,靶向 DCM 中的线粒体损伤有助于 DCM 患者的治疗[4]。
沉默信息调节因子 3(SIRT3)是烟酰胺腺嘌呤二核苷酸[Nicotine adenine dinucleotide(+),NAD+ ] 依赖性脱乙酰酶家族Sirtuins的成员之一,主要定位在线粒体内。SIRT3作为线粒体中重要的能量传感器,负责调节线粒体蛋白质的乙酰化,从而改善线粒体功能、保护细胞应激和心血管功能,被认为是 DCM 的潜在治疗靶点[5]。研究发现,链脲佐菌素 (STZ)与高脂饮食(HFD)诱导的 DCM 小鼠心脏中 SIRT3 表达减少,SIRT3 激活可以改善心功能[6]。 SIRT3缺陷小鼠 HFD 后表现出代谢综合征的加重,如加速胰岛素抵抗、肥胖、高脂血症和脂肪性肝炎等[7]。但 SIRT3 改善 DCM 患者心肌组织损伤的具体机制仍有待完善。因此,本文对SIRT3在DCM中的作用研究进展进行综述,旨在为糖尿病心血管并发症的研究提供理论基础和思路。
1 SIRT3与DCM
DCM由Rubler于1972年首次定义[8],是指在缺乏冠状动脉疾病、高血压和瓣膜性心脏病的情况下,糖尿病患者出现左心室重塑,最终导致心室收缩和(或)舒张功能障碍[9]。DM 相关的糖代谢紊乱引起DCM,主要病理特征为心肌细胞结构异常和局部微血管功能障碍。虽然 DCM 确切的病理生理机制尚未明了,但目前发现,氧化应激、线粒体功能障碍、内质网应激、炎症、自噬、Ca2+ 处理受损、心肌纤维化、脂毒性和心肌细胞死亡(如凋亡、坏死性凋亡、铁死亡、铜死亡和焦亡)等均与之相关(图1)。在这些机制中,线粒体功能障碍是导致糖尿病心肌代谢紊乱的重要原因。
Sirtuins 是 NAD+ 依赖性脱乙酰酶的高度保守家族,是体内必需的能量传感器,保护细胞免受代谢应激。Sirtuins 家族包含 7 个成员(SIRT1~SIRT7),分布在细胞内的不同位置。其中 SIRT3、SIRT4 和 SIRT5 定位在线粒体中,感知线粒体中的能量变化以维持机体的代谢和健康。研究表明线粒体蛋白的乙酰化只在 SIRT3 缺失的情况下增加,而不是 SIRT4 或 SIRT5 缺失[10]。这表明 SIRT3 通过脱乙酰化线粒体蛋白,在调节线粒体代谢中起重要作用。
SIRT3 蛋白全长有 399 个氨基酸残基,但未有特异性的酶活性。在易位到线粒体时,由线粒体加工肽酶作为“剪刀”切割,从而产生约为28 kDa的成熟 SIRT3 蛋白[11]。SIRT3 的中心酶促区域(氨基酸 126~399)高度保守,并以依赖于 NAD+ 的方式发挥脱乙酰酶活性。该中心区包含 1 个大的 Rossmann 折叠结构域和1个较小的锌结合结构域。结构域之间的裂隙为乙酰化底物提供了专门的结合位点,从而使SIRT3能够发挥脱乙酰化酶的功能[11]。定位于线粒体基质的 SIRT3 在心脏中的表达很高,主要在心肌细胞和平滑肌细胞中高表达,而线粒体在能量产生、代谢、细胞凋亡和细胞内信号传导中起关键作用。因此,如心脏、肾脏和大脑等高代谢组织对 SIRT3 参与调节的线粒体功能障碍更敏感。SIRT3 通过激活转录因子叉头盒 O1(,FOXO1)和叉头盒 O3(FOXO3),促进线粒体抗氧化因子的表达,如超含锰超氧化物歧化酶(MnSOD)和过氧化氢酶,以保护线粒体免受活性氧(ROS)损伤[12-13]。SIRT3的调节因子雌激素相关受体 α(ERRα)与过氧化物酶体增殖受体 γ 辅激活因子 α(PGC-1α)(一种众所周知的线粒体生物合成调节剂)协同作用,以增强核编码线粒体基因的表达,调节线粒体生物合成与线粒体自噬[14]。SIRT3 还会通过 NRF2 促进线粒体自噬和抑制线粒体的氧化应激,并与铁死亡通路相关[15-16];SIRT3还是线粒体未折叠蛋白响应(mtUPR) 中的重要相关因子,促进线粒体自噬过程[17]。此外,有研究发现 SIRT3 在内皮细胞中表达下降,导致一氧化氮(NO)的释放,影响血管舒张功能。SIRT3在 DCM 相关细胞中的表达水平可能影响能量代谢失调、心肌细胞损伤(如氧化应激、线粒体功能障碍、自噬、线粒体自噬等)、细胞死亡(如凋亡、焦亡等) 和内皮细胞功能障碍,最终导致心肌纤维化、心肌舒张和收缩功能障碍(图2)。
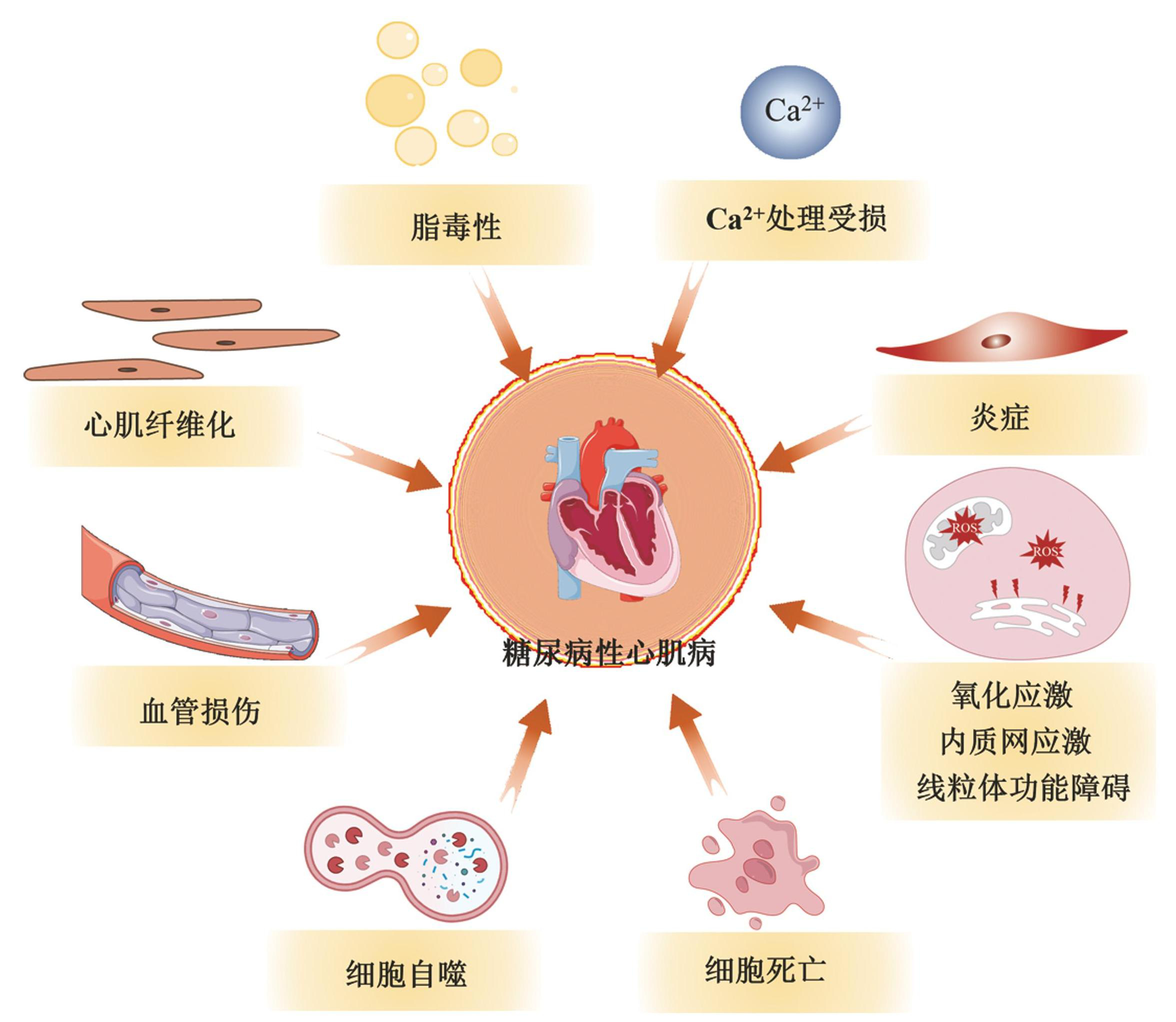
图1DCM的病理生理机制
2 SIRT3在DCM中的作用研究
2.1 SIRT3 在DCM能量代谢方面的研究
葡萄糖是心脏最有效的燃料,心肌细胞通过葡萄糖转运蛋白 1(GLUT1)和葡萄糖转运蛋白 4 (GLUT4)摄取葡萄糖,在胞质中发生糖酵解生成丙酮酸进入线粒体进入三羧酸循环,产生大量 ATP。但慢性高血糖会损害心肌细胞的胰岛素信号通路,导致心脏胰岛素抵抗,损害心肌细胞对葡萄糖的摄取,久而久之会损害心脏功能。研究表明,SIRT3通过上调腺苷酸活化蛋白激酶(AMPK)、Akt,下调缺氧诱导因子-1α(HIF-1α),脱乙酰化 PGC-1α 和丙酮酸脱氢酶(PDH)来改善肥胖小鼠心肌细胞的胰岛素抵抗[18-20]。另一方面,FOXO是SIRT3重要的下游靶标,调控细胞衰老、自噬、线粒体自噬、凋亡等信号通路以维持细胞稳态[21-23]。研究表明,SIRT3可以通过脱乙酰化 FOXO3改善细胞胰岛素刺激的葡萄糖摄取[24]。因此,SIRT3 对心肌细胞胰岛素敏感性升高和葡萄糖代谢的保护起重要作用。
在正常心脏中,心肌代谢的能量有 60 %~80 % 源于脂肪酸氧化,其余 20%~40% 来自葡萄糖和乳酸代谢[25]。胰岛素抵抗这种代谢的不灵活性迫使心脏更多地依赖脂肪酸氧化,葡萄糖的利用会进一步减少,而脂肪酸代谢异常会增加氧化应激,这与 DCM的发展具有密切关系。已有大量研究表明,在 2型糖尿病及DCM患者体内存在脂代谢紊乱,游离脂肪酸在体内过度蓄积,导致其毒性作用相应增大,致使心肌、微血管及神经受损,进而出现 DCM 等并发症[26]。高脂肪饮食(HFD)喂养的肥胖小鼠心脏中的 SIRT3 水平较低,而 SIRT3 基因敲除小鼠的心脏脂毒性较高[27-29]。SIRT3 可能通过促进脂质代谢、减少脂肪酸积累和氧化应激损伤来调节脂毒性和恢复心脏重塑[29]。此外,SIRT3 通过拮抗氧化应激诱导的细胞损伤来保护胰腺 β 细胞免受脂毒性[30]。这些实验表明,维持正常的脂质代谢对于心脏健康是必不可少的,并且 SIRT3 的正常表达也影响维持心脏中的脂质代谢。
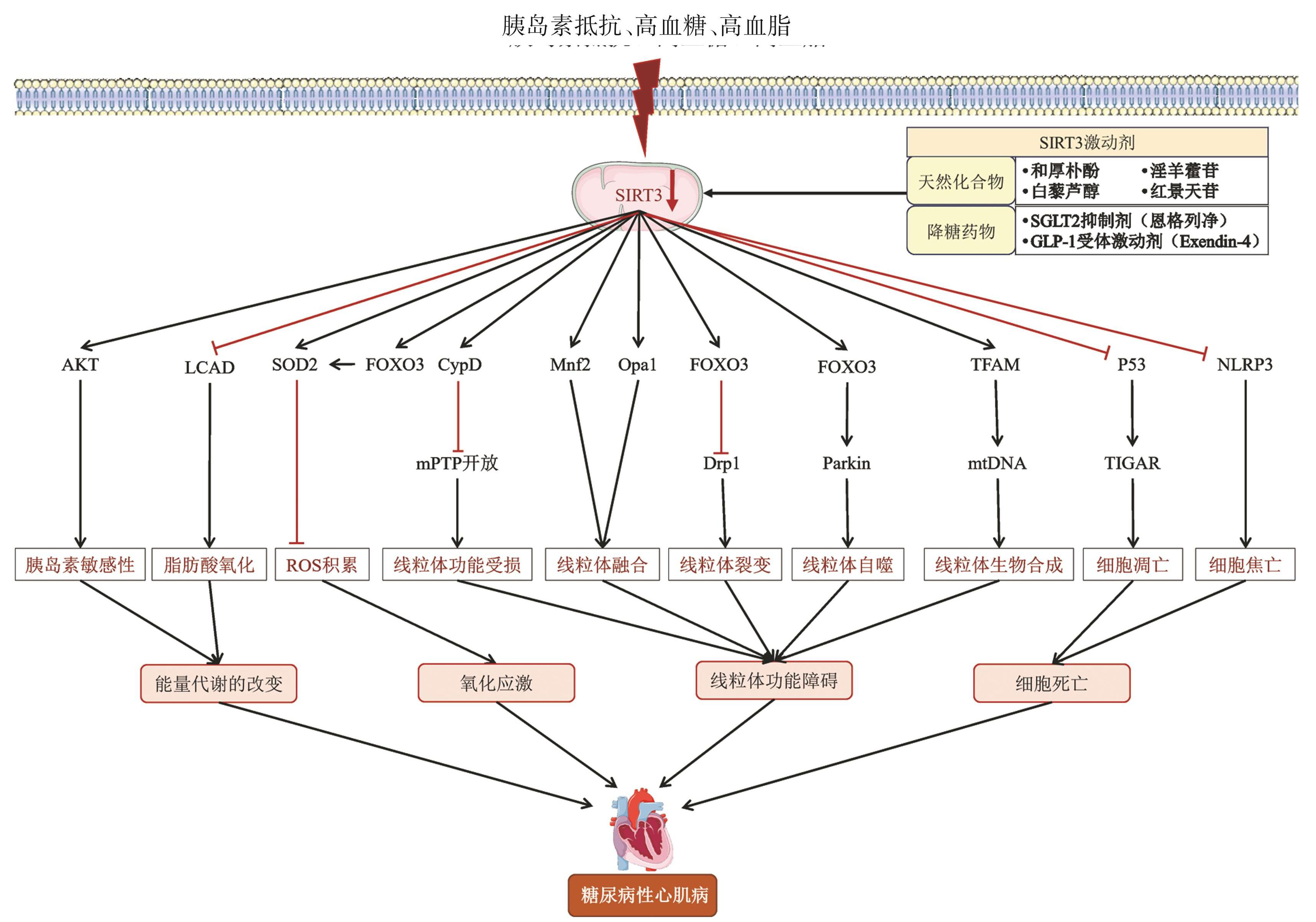
图2SIRT3调控DCM的机制
2.2 SIRT3 与DCM线粒体功能障碍的研究
生物体每天都需要消耗大量 ATP 来实现自身的能量稳态,其中大部分(>95%)来自线粒体的氧化磷酸化。虽然人心脏质量仅占身体质量的0.5%,但消耗了约 8% 的 ATP[31]。因此,与其他器官相比,心脏的线粒体含量最高[31]。糖尿病的糖脂代谢紊乱是心肌细胞产生过量 ROS 和线粒体呼吸链活性异常的主要原因。当线粒体合成和功能出现障碍,会严重影响 ATP 的产生,并诱导心损伤和死亡,进而导致心脏收缩功能障碍[4]。SIRT3 的缺失与心脏中 ROS 水平增加和线粒体功能障碍相关[32],而 SIRT3 的过表达被证明可以保护心肌细胞免受氧化应激和凋亡[33]。
2.2.1 SIRT3 与线粒体相关的氧化应激
在 DCM 进展的过程中,线粒体介导的氧化应激是重要的机制之一。健康心脏中通常会产生少量 ROS,而糖尿病中,心肌组织的ROS水平主要通过两种不同的机制明显增加。首先是 ROS 的产生增多。线粒体相关ROS的来源主要是呼吸链,氧气分子如果不是在复合物Ⅳ获取 2 个电子生成水,而是在复合物Ⅰ、 Ⅱ、Ⅲ获取了自由电子,就会产生 ROS[包括超氧阴离子(·O2-),双氧水(H2O2)和羟自由基(·OH)等],产生的自由基会肆意抢夺其他蛋白质、脂质和核酸的电子来保持自身的稳定性,引起细胞内的蛋白质、脂质和核酸损伤,进而对细胞膜、蛋白质和DNA 结构造成破坏[34]。此外,单胺氧化酶(MAOs)和 NADPH 氧化酶 4(NOX4)分别引起 H2O2和 O2-产生增多也可能在 DCM 发展中引起 ROS 过载[35-36]。第二种机制是 ROS 清除减少。在正常生理条件下, ROS 会被线粒体抗氧化酶和分子清除,如 MnSOD 和谷胱甘肽过氧化物酶(GPX)[37-38]。最近一些研究发现,在 DCM 进展中,心肌组织中的这些抗氧化因子急剧下降,线粒体的抗氧化能力明显减弱,表现为氧化还原失衡和线粒体诱导的氧化应激[39-40]。过量的 ROS会诱导脂质过氧化和线粒体DNA(mtDNA)的氧化损伤,并延长线粒体通透性转换孔(mPTP)开放时间和降低 ATP 水平。这些共同造成了线粒体凋亡途径的启动,导致心脏功能障碍。
SIRT3 在 DCM 中的改善作用主要是其对 ROS 的清除作用。MnSOD 作为 SIRT3 最重要的脱乙酰化底物之一,在清除 ROS 过程中发挥着关键作用。 Sultana 等[41] 发现,链脲佐菌素(STZ)诱导的 1 型糖尿病大鼠的心脏中 ROS 水平升高,过氧化氢酶和 SOD 活性降低,服用大蒜后激活了 SIRT3的表达活性,SIRT3 与线粒体必需的抗氧化酶 MnSOD 结合,使其脱乙酰化和活化,进而减少 ROS,保护小鼠免受氧化应激。此外,SIRT3 可以通过脱乙酰化转录因子 FOXO3来增强 MnSOD的转录,从而抑制线粒体氧化应激[32]。如上所述,SIRT3 可能通过直接或间接的方式激活抗氧化酶来保护线粒体免受氧化应激,并增加ATP的水平。
SIRT3 不仅是一种有效的自由基清除剂,具有抗氧化潜力,而且还可以脱乙酰化亲环蛋白 D (CypD)以减少其诱导的mPTP开放[42-43]。高血糖诱导的 ROS 过度产生会延长 mPTP 的开放时间,从而降低线粒体膜电位,进而影响ATP合成[42-44]。此外, mPTP 开放允许水分渗透到线粒体中,导致线粒体膨胀并最终破裂, ATP 生成减少 [45];线粒体内的凋亡因子会释放到细胞质中,从而诱导细胞凋亡[46]。已在肥胖左心衰患者和蔗糖诱导的代谢综合征大鼠模型的心脏组织中证实了SIRT3表达下降,CypD 的乙酰化水平明显升高,增加了mPTP开放度,表现为氧化应激水平增强和明显的心室功能障碍[42]。以上结果说明DCM心肌功能障碍的发展中,SIRT3下降通过底物蛋白 CypD 的乙酰化增加导致 mPTP的过度开放,线粒体功能受损,从而影响心肌细胞对氧化应激的抵抗力与细胞程序性死亡。SIRT3的激活导致的 mPTP 开放度下降可能是潜在靶点,但仍需更多的实验探究并验证SIRT3是否能通过维持线粒体稳态来减缓DCM心功能障碍的进展。
2.2.2 SIRT3与线粒体动力学
线粒体动力学是指线粒体不断进行融合和裂变的循环过程,这有助于调节线粒体的稳态和生物合成,以维持能量产生和 ROS平衡。线粒体融合由线粒体融合蛋白 1或者 2 (Mfn1,Mfn 2)和视神经萎缩因子 1(Opa1)介导;而裂变主要与动力相关蛋白 1(Drp1)、线粒体裂变蛋白 1(FIS1)、线粒体裂变因子(MFF)和线粒体裂变过程1(MTFP1)等相关[47]。在高血糖诱导的H9c2细胞中,线粒体可通过 Drp1 信号转导诱导分裂,从而导致 ROS的过量产生[48];类似的,通过向 db/db小鼠的心脏中注射 Mfn2 过表达腺病毒,抑制了线粒体裂变及线粒体依赖的细胞凋亡,并延缓了 DCM 的进展[49]。在心肌梗死诱导的心肌损伤模型中,脂肪因子 Omentin1可以增强心肌细胞 SIRT3/FOXO3信号传导,改善线粒体融合-裂变动力学相关蛋白的失衡(p-Drp1 下调,Mfn2 和 OPA1 表达上调),促进线粒体融合并抑制裂变,从而改善心力衰竭。此外,Ni 等在 DCM 动物和细胞模型中发现了淫羊藿苷(一种从淫羊藿中分离出来的黄酮类单体)通过 Apelin/SIRT3 通路增加了 PGC-1α、Mfn2 和 Cyt-b 的蛋白表达,阻止线粒体功能障碍[50]。
2.2.3 SIRT3与线粒体生物合成
线粒体生物合成与受损线粒体的消除也处于一种动态平衡中,这种平衡与维持细胞线粒体正常功能有关。线粒体生物发生的标志包括 mtDNA 拷贝数、mtDNA 与 nDNA比值和线粒体基因表达水平的升高[51]。线粒体是半自主的细胞器,mtDNA编码37个基因,13种蛋白质。mtDNA受损对线粒体电子传递链(ETC)蛋白影响非常大,因为大多数线粒体呼吸链蛋白都是由 mtDNA 编码的[52]。Cividini 等[53] 报道了在 1 型糖尿病小鼠中氧化应激诱导的 mtDNA 损伤。线粒体转录因子A(TFAM)是唯一参与编码线粒体ETC复合物蛋白质的 mtDNA 转录的线粒体转录因子,因此对于维持 mtDNA 的稳定以及转录至关重要[54]。 Bagul等[55] 用 STZ构建了雄性 Sprague‒Dawley(SD) 大鼠糖尿病模型来研究线粒体功能障碍,发现糖尿病模型的心脏中 SIRT3 与 TFAM 蛋白表达下调,线粒体 ETC 复合物活性降低。H9c2 细胞敲除 SIRT3 使TFAM乙酰化水平增加,TFAM与mtDNA结合活性下降,导致 mtDNA 转录减少和线粒体功能障碍,证实 SIRT3 参与了 TFAM 对线粒体生物合成的调节[55]。
2.2.4 SIRT3与线粒体自噬
线粒体自噬主要是在营养缺乏或线粒体膜电位降低的情况下触发的。线粒体自噬通过自噬膜包裹受损的线粒体形成自噬小体,与溶酶体融合,介导异常线粒体降解,从而防止氧化应激并减少心肌细胞凋亡。线粒体自噬的病理生理过程主要分为 3 个阶段:线粒体自噬的启动、线粒体自噬体的形成和线粒体自噬体的降解。据报道,AMPK-哺乳动物雷帕霉素靶蛋白 (mTOR)、胰岛素信号转导和 Wnt/β-catenin 通路参与线粒体自噬的启动;PTEN诱导的激酶1(PINK1)/ Parkin、线粒体自噬受体 FUN14 结构域 1 (FFUNDC1)和 BNIP3/NIX 通路与线粒体自噬体的形成有关。其中,诱导线粒体自噬的经典途径涉及 PINK1及其底物 Parkin[56]。越来越多的研究结果表明,平衡线粒体生物发生和线粒体自噬对于维持 DCM中的细胞代谢至关重要,线粒体自噬失调加剧了 DCM 的进展[57-58]。Tong 等[59] 表明,Parkin 介导的线粒体自噬可保护心脏免受HFD诱导的心脏肥大,舒张功能障碍和脂质积聚,此外,Tat-Beclin 1(自噬诱导剂)治疗可缓解 HFD 诱导的心功能障碍。同样,Wu等[60] 发现,线粒体自噬受体 FUNDC1的缺乏会损害线粒体质量,并加重饮食诱导的肥胖和代谢综合征。 SIRT3-FOXO3Parkin 信号通路可能在 DCM的发展中起着至关重要的作用[21]。此外,褪黑激素可以通过MST1/SIRT3信号传导上调自噬及线粒体自噬,减少细胞凋亡,调节线粒体完整性和生物发生来保护 DCM[61-62]。白藜芦醇(一种 SIRT3 的激动剂)通过上调 SIRT3 和 AMPK 来促进自噬[63]。在糖尿病心肌梗死后模型中,apelin通过上调SIRT3 来增加自噬改善心力衰竭[64]。以上结果表明 SIRT3 作为心脏能量代谢调节的关键蛋白,在不同心衰模型中采用不同的激动剂可以激活 SIRT3调节 Parkin 信号通路相关的线粒体自噬。
DCM 的关键病理之一是线粒体功能障碍。线粒体融合和裂变(线粒体动力学)、线粒体生物发生和线粒体自噬是线粒体质量控制的重要组成部分[65]。这种平衡如果失调会破坏线粒体在细胞内的稳态与功能,增加ROS的积累。因此,SIRT3参与并调控糖尿病心肌细胞中线粒体质量控制,以此为靶点进行干预可能有助于延缓DCM的发展。
2.3 SIRT3在DCM心肌细胞死亡方面的研究
DCM 的发病机制包括糖脂代谢紊乱、氧化应激、炎症反应、线粒体损伤、铁超载和钙超载。DCM 的结果都是心肌细胞死亡。心肌细胞死亡被认为是心力衰竭、心肌梗死和 DCM 等多种心血管疾病的基本病理过程。因此,减少心肌细胞死亡是改善和恢复DCM心脏功能的关键。
2.3.1 SIRT3 与细胞凋亡
细胞凋亡在 DCM 的进展和发病机制中起着关键作用。高血糖和其他代谢异常引起氧化应激、线粒体功能障碍和炎症从而导致心肌细胞发生凋亡。心脏细胞凋亡增加会导致纤维化和心脏功能障碍。线粒体是凋亡途径的重要参与者,SIRT3 作为一种线粒体代谢的重要组成成员,关于SIRT3在DCM中的积极作用已经有了相关的报道。TP53 诱导的糖酵解和细胞凋亡调节因子(TIGAR)参与各种生物过程,包括糖酵解代谢、细胞凋亡、细胞周期和细胞死亡[66]。Li 等[67] 发现,体内注射SIRT3过表达腺病毒显著提高了db/db 小鼠的心脏功能,抑制转录因子 P53 的乙酰化水平及其下游靶基因 TIGAR 的表达,表现为降低 ROS 水平,糖酵解恢复及抑制了心肌细胞凋亡,有趣的是SIRT3过表达还减弱了心脏微血管稀疏。
2.3.2 SIRT3与细胞焦亡
细胞焦亡是一种新发现的与炎症相关的程序性细胞死亡,其特征是细胞肿胀、质膜破裂和炎性细胞内容物的释放。NLRP3炎症小体介导的半胱天冬酶-1(Caspase-1)依赖性焦亡是一种典型途径。DCM 的炎症反应与细胞焦亡密切相关,NLRP3 炎症小体介导的心肌细胞焦亡是 DCM 的关键参与者[68-69]。有研究发现,在人心室肌细胞中,高糖诱导 NLRP3、Caspase-1 和 IL-1β 蛋白表达明显增加,且伴有明显的心肌细胞焦亡[70]。类似地,在 STZ诱导的糖尿病模型大鼠和高糖诱导的 H9c2细胞中,NLRP3和 IL-1β 的表达比对照组显著增加[71],而沉默 NLRP3 基因可改善心脏炎症和焦亡,并改善糖尿病大鼠模型和H9c2心肌细胞的心脏功能[72]。这些发现证实了 NLRP3 炎症小体介导的细胞焦亡在 DCM 中的独特作用。最近有多个研究报道了SIRT3介导NLRP3炎症小体在DCM中的调节作用。Song 等[73] 发现,SIRT3 在糖尿病小鼠的心肌中表达下降,SIRT3 敲除糖尿病小鼠心肌细胞中坏死性凋亡相关蛋白如受体相互作用蛋白激酶 (RIPK)1/3 和 NLRP3 炎性小体的表达水平远高于野生型糖尿病小鼠。此外,在高糖诱导的H9c2细胞中也发现了焦亡和炎症相关蛋白(NLRP3、 GSDMD-N、cleaved caspase-1、IL-1β 和 IL-18)的表达上升,激活了 SIRT3 后抑制了高糖介导的细胞焦亡[74]。尽管如此,SIRT3信号通路靶向调节DCM 细胞焦亡确切机制的直接证据尚未明了,仍有待更深入的研究。
2.4 SIRT3 在DCM内皮细胞功能障碍方面的研究
DCM 患者体内的高血糖、高血脂、炎症和氧化环境促进了冠状小动脉硬化的进展,微血管功能障碍在 DCM 的发展中起着重要作用。SIRT3 参与调节糖尿病患者和肥胖症患者的血管功能障碍的调节,主要的功能是协调氧化代谢和控制 ROS 稳态,减少内皮细胞损伤[75-77]。最近有文献报道,在糖尿病患者的内皮祖细胞中,高糖诱导了ROS的生成和线粒体依赖的细胞凋亡,胰高血糖素样肽-1(GLP-1) 受体激动剂 Loxenatide 通过 SIRT3/FOXO3 信号通路保护内皮祖细胞免于高糖诱导的线粒体功能障碍和细胞凋亡[78]。此外,在高糖诱导的人主动脉内皮细胞中,SIRT3 过表达显著改善了过氧化物酶体增殖激活受体 α 和内皮型一氧化氮合酶(eNOS)表达并抑制诱导型一氧化氮合酶(iNOS)水平[79]。另外有研究者在棕榈酸诱导的胰岛素抵抗人内皮细胞模型中,通过模拟转染 SIRT3,抑制了 NLRP3/ caspase-1 轴介导的自噬、炎症和焦亡,维持氧化还原稳态,减少细胞死亡[80]。以上结果说明内皮 SIRT3可能通过对线粒体功能的保护作用提高了内皮细胞的抗氧化能力以及血管完整性,防止血管功能障碍和心功能障碍。
异常血管生成可能损害心肌毛细血管,减少氧气和营养供应,加重糖尿病相关的心力衰竭[81-83]。血管生成需要一系列高度协调的事件,涉及内皮细胞、细胞外基质和生长因子之间的广泛相互作用[84-87]。有研究者发现SIRT3敲除的内皮细胞,减少了内皮细胞管的形成、迁移和主动脉出芽[88]。此外, Apelin 是一种具有强效血管生成活性的生物活性肽,由内皮细胞分泌促进血管生成并参与调节心脏[89-90]。在 STZ诱导及永久性冠状动脉结扎的糖尿病模型小鼠中,Apelin 基因疗法可减轻心肌细胞凋亡并改善心脏收缩功能,而这些保护作用在 SIRT3 基因敲除小鼠中不存在[91]。这项研究表明,在糖尿病小鼠模型中,SIRT3 在 Apelin 介导的血管生成中发挥直接的作用。但 SIRT3 在 DCM 血管生成中的作用仍需更多的研究来全面阐明。
He等[88] 发现与野生型小鼠相比,内皮细胞特异性敲除 SIRT3的小鼠中,糖酵解酶 6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶 3(PFKFB3)显著降低,糖酵解功能受损。有趣的是,SIRT3 的缺失增加了内皮细胞的耗氧率和ROS的产生。与此结果一致的是,有文献报道了高脂饮食诱导的肥胖小鼠的血管舒张受损,内皮 SIRT3 表达下降,线粒体 ROS 积累并损害了胰岛素信号传导,SIRT3 基因敲除加剧了这种损伤[75]。此外,Zeng 等[92] 发现内皮 SIRT3 可能调节心肌细胞葡萄糖利用率,并影响心脏功能。具体而言,SIRT3 敲除破坏了葡萄糖从内皮细胞到心肌细胞的转运,以旁分泌方式通过心脏调节蛋白 Apelin 来减少心肌细胞葡萄糖利用,并防止压力超负荷诱导的心力衰竭。这些数据表明,SIRT3 表达下降与内皮细胞代谢改变、胰岛素抵抗增加、氧化应激和耗氧量增加有关,这些变化可能会限制心肌细胞获得氧气与能量,从而可能导致心脏缺氧和功能障碍。由于血管生成和心脏调节蛋白的分泌高度依赖于糖酵解,因此内皮 SIRT3 的破坏和糖酵解代谢的重编程可能导致 DCM 中的冠状动脉微血管稀疏和心肌损伤。
综上所述,在高糖、高脂的环境中,SIRT3 的激活可以减少内皮细胞凋亡与胰岛素抵抗,改善了内皮生成障碍,对血管内皮功能具有保护作用,延缓 DCM的发生发展。
3 SIRT3激活剂在DCM中的应用
SIRT3 是线粒体代谢和能量学的关键调节因子,有必要开发靶向SIRT3治疗DCM的药物。在治疗上,可以通过使用 SIRT3 激活剂或增加线粒体 NAD +水平来增强SIRT3活性和表达[93-94]。
虽然研究人员开发了很多药物用于激活SIRT3 的活性,但可以特异性调节DCM中SIRT3活性的药物仍然有限。和厚朴酚是一种来源于厚朴树皮的天然木脂素,是最广泛使用的 SIRT3 激活剂之一。和厚朴酚增加 SIRT3 表达和脱乙酰活性,增强线粒体功能,改善 DCM 中的线粒体能量学失衡[95]。此外,许多其他天然产物(如白藜芦醇、淫羊藿苷和红景天苷)已被证明正向调节SIRT3的表达和活性,降低心肌细胞氧化应激,改善DCM。
研究发现,用于治疗 2 型糖尿病的降糖药能上调SIRT3表达。最近的一项研究结果表明,钠-葡萄糖协同转运蛋白 2(SGLT2)抑制了肾近端小管中上皮向间充质的转化和纤维化;SGLT2抑制的这种作用与其恢复SIRT3表达和糖酵解的能力有关[96]。此外,恩格列净显著增加糖尿病模型大鼠心肌 SIRT3 和SOD2水平,抑制ROS产生,改善心肌梗死后的左心室功能[97]。类似地, GLP-1 类似物 Exendin-4(一种 GLP-1 受体激动剂)也能显著激活 SIRT3[98]。降糖药物 SGLT2抑制剂和 GLP1受体激动剂对 SIRT3 的药理学激活可能是预防不良心脏重塑的潜在治疗策略。
尽管上述化合物不是 SIRT3 的特异性激活剂,但目前的实验证据说明 SIRT3 激活在 DCM 中有一定的治疗前景,未来仍需设计更多的 SIRT3 的靶向小分子激活剂。许多临床试验(如NCT03491241和 NCT02011906)研究了 SIRT3 激活在糖尿病相关的心血管疾病中的治疗潜力,然而仍需要更多的研究来评估长期激活SIRT3的不良影响。
4 结语与展望
近年来的研究结果证明,SIRT3 在 DCM 发生、发展中发挥不可或缺的作用。SIRT3可以通过调节糖脂代谢、改善胰岛素抵抗、改善氧化应激、线粒体自噬、调节细胞死亡、改善内皮细胞功能等途径延缓 DCM 的进展(图2)。然而,SIRT3 心脏保护作用的潜在机制极其复杂,仍有待进一步阐明。但就临床实践应用而言,迄今仍未发现 SIRT3 特异性激活剂并用于 DCM 的预防或治疗。目前发现了天然化合物(如和厚朴酚和白藜芦醇)与降糖药物可以有效激活SIRT3并在DCM中表现出一定的治疗作用; 然而,其有益作用并不完全归因于SIRT3的激活,但是随着对 SIRT3 这个新的治疗靶点研究的深入,未来可能成为治疗DCM的方向之一。

