摘要
目的 探讨术前白蛋白与碱性磷酸酶比值(AAPR)联合全身炎症反应指数(SIRI)与根治性切除胃癌患者临床病理特征及预后的相关性。方法 该研究为回顾性研究,收集2018年8月至2020年12月广东医科大学附属医院胃肠外科收治的行胃癌根治术治疗患者241例的临床资料,计算出AAPR、SIRI数值。通过ROC曲线确定 AAPR和SIRI的最佳截断点。结合两个指标构建AAPR-SIRI评分,通过χ2 检验分析AAPR-SIRI评分与胃癌的病理特征关系;以Kaplan-Meier法描绘生存曲线;用Cox比例风险回归模型进行单因素和多因素分析。结果 (1)肿瘤直径、TNM分期、有无神经侵犯、有无脉管癌栓、生存时间在AAPR-SIRI评分0、1、2分组的组间差异有统计学意义(P< 0.05),高分组患者可能肿瘤直径更大、TNM 分期更晚、神经脉管更易侵犯、生存时间更短;(2)生存分析显示, AAPR-SIRI 0、1、2分组的 3 a生存率分别为 81.08%、57.47%和 41.25%,3组间的差异有统计学意义(P< 0.05),较高的AAPR-SIRI评分与较低的生存率有关;(3)多因素Cox分析结果显示:AAPR-SIRI评分、Lauren分型、TNM、含印戒细胞癌均是影响胃癌患者预后的独立危险因素(均P< 0.05)。结论 (1)AAPR-SIRI评分与胃癌患者肿瘤直径大小、病理分期、神经脉管侵犯等临床病理特征存在相关性;(2)术前 AAPR与 SIRI联合应用有助于评估胃癌患者的预后。
关键词
Abstract
Objective To investigate the correlation between preoperative albumin to alkaline phosphatase ratio (AAPR)combined with systemic inflammatory response index (SIRI) and the clinicopathological characteristics and prognosis of patients with radically resected gastric cancer. Methods A total of 241 patients admitted to the Department of Gastrointestinal Surgery of the Affiliated Hospital of Guangdong Medical University for radical gastric cancer treatment during the period of August 2018 to December 2020 were selected. The clinical data of the patients were collected, and the values of the AAPR and the SIRI were calculated. The optimal cut-off points for AAPR and SIRI were determined by ROC curves. The AAPR-SIRI score was constructed by combining the two indexes, and the relationship between the AAPR-SIRI score and the pathological characteristics of gastric cancer was analyzed by the χ2 test; the survival curve was depicted by the Kaplan-Meier method; and unifactorial and multifactorial analyses were carried out by the Cox proportional hazards regression model. Results (1) The AAPR-SIRI scores of the 0, 1, and 2 groups showed statistically significant differences in tumor diameter, TNM stage, presence or absence of nerve invasion, presence or absence of choroidal cancer embolism, and survival time when compared between groups (P<0.05). The patients with high scores may have larger tumor diameters, later TNM stages, easier invasion of nerves and vessels, and shorter survival times. (2) Survival analysis showed that the three-year survival rates of AAPR-SIRI subgroups 0, 1, and 2 were 81.08%, 57.47%, and 41.25%, respectively, and the differences among the three groups were statistically significant (P<0.05), with higher AAPR-SIRI scores associated with lower survival rates. (3) The results of multifactorial Cox analysis showed that AAPR-SIRI score, Lauren staging, TNM, and indwelling ring cell-containing carcinoma were independent risk factors affecting the prognosis of patients with gastric cancer (all P<0.05). Conclusion (1) There is a correlation between AAPR-SIRI score and clinicopathological features such as tumor diameter size, pathological stage, and neurovascular invasion in patients with gastric cancer. (2) AAPR-SIRI score, Lauren staging, TNM staging, and the presence of indolent cell carcinoma are independent risk factors for prognosis in patients with gastric cancer.
胃癌是起源于胃黏膜上皮细胞的恶性肿瘤,占胃恶性肿瘤的 95% 以上。2020 年全球新发胃癌病例数在所有新发癌症病例中排名第五,死亡病例数排名第四[1]。胃癌起病隐匿,早期症状不明显,被确诊时大多已处于进展期,预后较差。在临床应用中,CT、PET-CT、肿瘤标志物、循环肿瘤细胞等辅助检查对胃癌筛查、动态监测、评估预后有一定的指导作用。但这些辅助检查存在价格昂贵、缺乏特异性与灵敏性、患者依从性较差等缺点,近年来使用血常规、生化等检验指标来评估患者预后的研究越来越多,诸多学者发现营养、炎症状态与癌症发生、发展息息相关[2-4],中性粒细胞/淋巴细胞比值、纤维蛋白原/白蛋白比值、白蛋白与碱性磷酸酶比值 (AAPR)及全身炎症反应指数(SIRI)等非特异性指标与癌症进展和预后存在密切联系[5-7]。本研究旨在探讨 AAPR 联合 SIRI 与胃癌患者临床病理特征的相关性及评估预后的价值。
1 资料和方法
1.1 临床资料
本研究为回顾性研究,将2018年8月至2020年 12月在广东医科大学附属医院胃肠外科241例接受根治胃癌切除术的患者作为研究对象。241 例中,男136例,女105例;年龄34~87岁,中位年龄63岁。均符合本研究的纳入和排除标准。纳入标准:(1) 符合《胃癌诊疗指南》(2022 年版)中关于胃癌的诊断标准,经病理初次确诊为原发性胃癌;(2)行根治性胃癌切除术。排除标准:(1)术前/术中发现远处转移;(2)术前接受新辅助化疗、放疗等抗肿瘤治疗;(3)合并其他恶性肿瘤、代谢性慢性疾病;(4)合并血液、免疫系统疾病;(5)合并肝、肾、肺等重要脏器功能障碍或衰竭;(6)近期发现感染或发现有感染征象者。本研究经广东医科大学附属医院伦理委员会审批通过(文件批号:PJKT2023-073)。
1.2 方法
1.2.1 研究资料
患者的一般资料,如性别、年龄; 病理资料,如肿瘤位置、肿瘤直径、Lauren 分型、淋巴结转移情况、肿瘤浸润深度、病理分期、分化程度、是否含有印戒细胞、是否有神经侵犯、是否有脉管癌栓等;术前检验资料,包括血清白蛋白、碱性磷酸酶、中性粒细胞计数、单核细胞计数、淋巴细胞计数等。AAPR = 血清白蛋白/碱性磷酸酶,SIRI = 中性粒细胞计数 ×单核细胞计数/淋巴细胞计数,根据公式计算出 AAPR、SIRI数值。通过 ROC曲线确定 AAPR 截断值,根据截断值对患者进行评分,分析 AAPR联合SIRI与胃癌患者临床病理特征及预后的相关性。
1.2.2 AAPR-SIRI 评分分组
采用 ROC 曲线确定 AAPR和SIRI的最佳截断值。根据截断值将AAPR 和 SIRI 进行分组,AAPR-SIRI 评分计算如下:患者术前 AAPR水平低于截断值且 SIRI高于截断值,则该患者评为 2 分;若患者术前 AAPR 水平高于截断值或 SIRI 低于截断值,二者只有其一,则该患者评为 1 分;若患者 AAPR 水平高于截断值且 SIRI 低于截断值,其评为0分。
1.2.3 随访
对研究对象通过电话、门诊、住院复查等方式进行随访,术后 24个月内每 3~6个月随访 1次,24个月后每年随访 1次,所有患者术后均随访 36个月,随访患者生存情况。研究结局为总生存期 (overall survival,OS),OS定义为术后第1天至死亡或随访结束的时间。
1.2.4 统计学处理
采用 SPSS 25.0 软件进行统计学处理。分类资料以例数(百分比)表示,组间比较采取卡方检验;符合正态分布的连续性资料以均数 ± 标准差表示,不符合正态分布的连续性资料以中位数(P25,P75)描述;采用 Kaplan-Meier 法描绘生存曲线;采用 Cox比例风险模型对预后进行单因素和多因素分析。以 P<0.05 表示差异有统计学意义。
2 结果
2.1 AAPR、SIRI最佳截断值的确定及分组
将纳入本次研究的 241 名患者的术前 AAPR、 SIRI值构建 ROC 曲线(见图1),找出约登指数最高的数值作为 AAPR、SIRI 的截断值。AAPR、SIRI 的最佳截断值分别为 0.57(95%CI 0.670~0.797)、1.15 (95%CI 0.671~0.802),AUC 分别为 0.733、0.736。根据最佳截断值将患者分为 AAPR-SIRI 0 分组(74 人)、1分组(87人)、2分组(80人)。见表1。
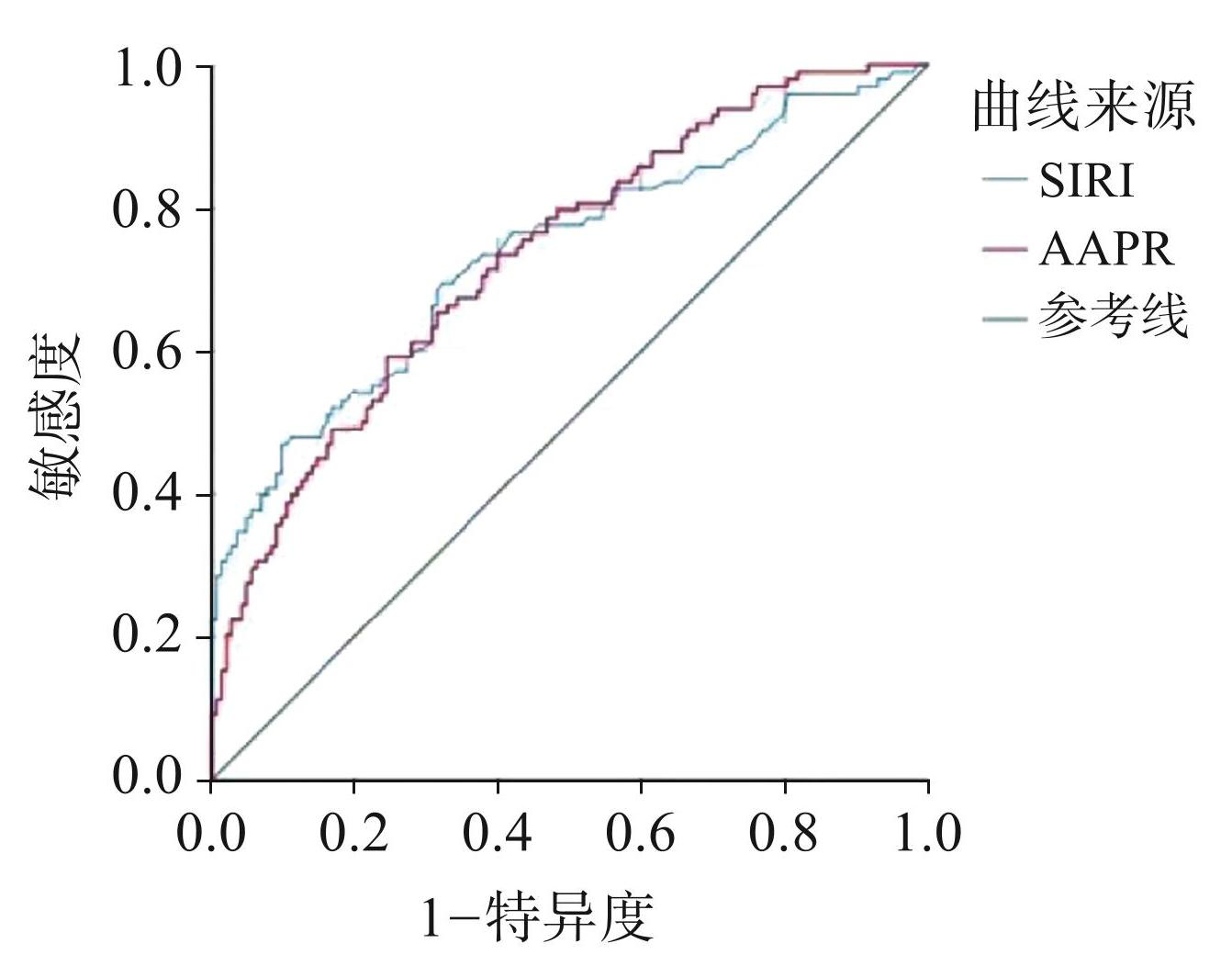
图1AAPR、SIRI ROC曲线分析
2.2 AAPR-SIRI 评分与患者临床病理特点的关联性分析
AAPR-SIRI 评分 0、1、2 分组在肿瘤直径、TNM 分期、有无神经侵犯、有无脉管癌栓、生存时间组间差异有统计学意义(P<0.05)。在性别、肿瘤位置、 Lauren分型、浸润深度、N分期、分化程度、是否含有印戒细胞癌、年龄、CEA 水平、CA199 水平、CA125 水平组间比较差异无统计学意义(P >0.05)。见表2。
2.3 AAPR-SIRI联合评分与胃癌患者的生存分析
根据 AAPR、SIRI 最佳截断值将患者分为 AAPR-SIRI 0、1、2 分组,0 分组患者 3 a 生存率为 81.08%,1分组为57.47%,2分组为41.25%,3组间差异有统计学意义(P<0.05)。对于胃癌患者,AAPR-SIRI联合评分越高,其3 a生存率越低。AAPR-SIRI 联合评分与胃癌患者术后的生存曲线见图2。
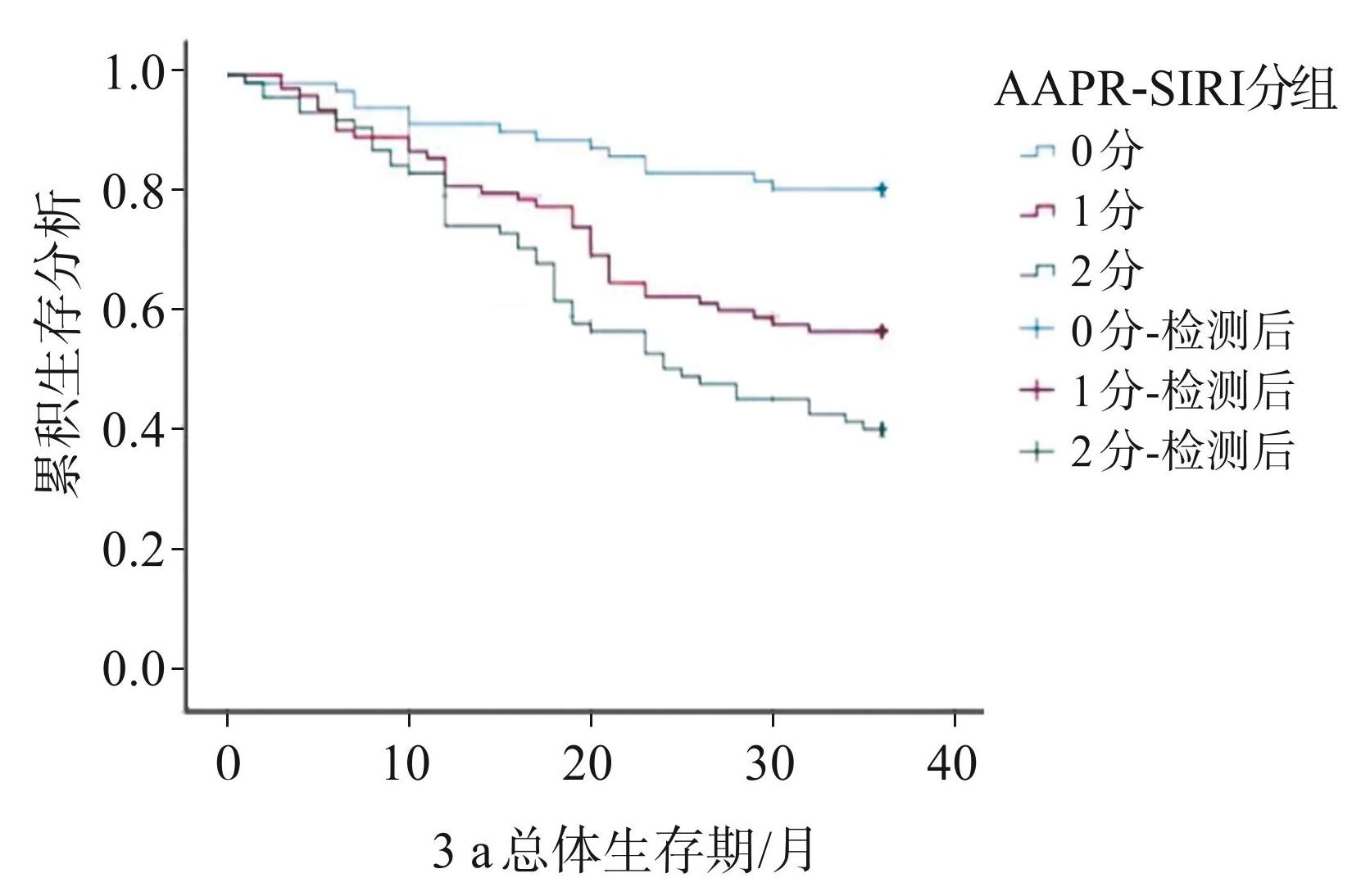
图2AAPR-SIRI评分与胃癌患者术后3 a总体生存期的 Kaplan⁃Meier 曲线
2.4 影响患者总体生存期的单因素Cox分析
对可能影响胃癌患者术后生存期的研究因素进行单因素分析,结果显示:AAPR-SIRI 评分、 Lauren 分型、浸润深度、TNM 分期、肿瘤直径 ≥ 4.2 cm、含印戒细胞癌、有脉管癌栓对患者生存期的影响差异有统计学意义(均P<0.05)。见表3。
2.5 影响患者总体生存期的多因素Cox分析
将单因素分析差异有统计学意义的观察因素使用 Cox 回归模型进行多因素分析,结果显示: AAPR-SIRI评分分组中,与0分组相比,1分组(HR= 2.076,95%CI 1.113~3.871,P= 0.022)、2 分组(HR= 2.823,95%CI 1.534~5.197,P= 0.001)对生存时间的影响差异有统计学意义;Lauren 分型中弥漫型预后较差,与弥漫型相比,肠型(HR= 0.347,95%CI 0.197~0.612,P<0.001)、混合型(HR=0.419,95%CI 0.220~0.799,P= 0.008)预后较好;TNM 分期中,与 I 期相比,Ⅱ期(HR= 3.612,95%CI 1.750~7.458,P= 0.001)、Ⅲ期(HR= 5.061,95%CI 2.523~10.151,P<0.001)对生存时间的影响差异有统计学意义;含印戒细胞癌(HR= 1.791,95%CI 1.185~2.707,P= 0.006)对生存时间的影响差异有统计学意义。其他指标对总生存时间的影响差异无统计学意义(P>0.05)。见表4。
表1AAPR、SIRI的最佳截断值与AUC的比较
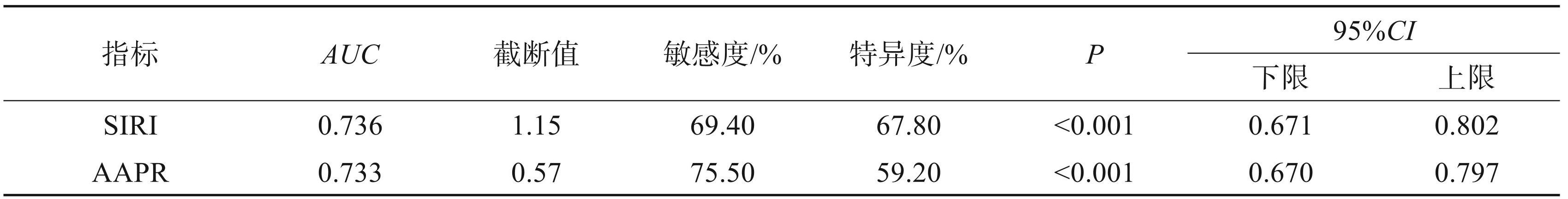
表2患者基础资料和AAPR-SIRI评分各组与胃癌患者的临床病理特征的关系
表3影响胃癌患者总体生存期的单因素Cox分析
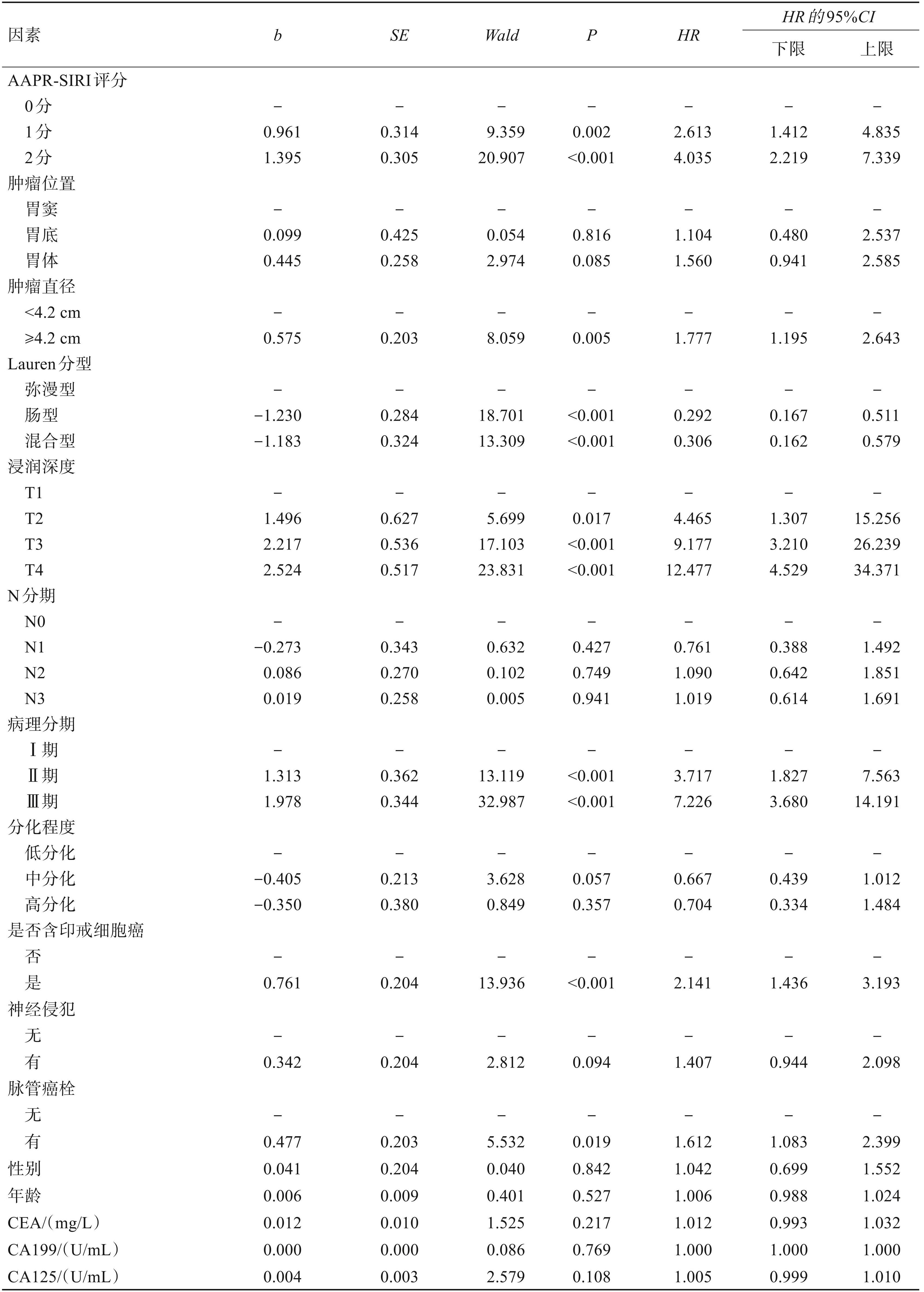
表4影响胃癌患者总体生存期的多因素Cox分析

3 讨论
胃癌是消化系统最常见的恶性肿瘤之一,男性发病人数多于女性,以中老年患者为主[8]。目前,临床上主要用 TNM 分期来评估患者预后,指导临床后续治疗方案的选择。但 TNM 亦有其局限性,目前在临床上对部分淋巴结的清扫和数量仍然存在争议,有可能导致 TNM 分期出现偏差,影响后续治疗方案[9]。此外,即使手术方式、TNM 分期相同,不同患者的预后各有不同。为能更准确地评估胃癌患者的预后,实施精准治疗,提高患者生存期和生活质量,学者们围绕影响胃癌患者预后的因素进行了大量的研究。近年来,临床常用检验指标如血常规、生化指标等成为研究的热点,越来越多的血液学指标及其衍生指标被证实与胃癌患者预后相关[10-12]。
白蛋白是由肝脏合成的一种球形蛋白质,参与 DNA 复制、细胞增殖。白蛋白水平降低,其抗氧化作用减弱,破坏了 DNA 复制的稳定性,促进癌症的发生[13]。Sun 等[14] 发现,当患者白蛋白小于 35 g/L 时,胃癌患者术后放疗发生不良事件(如贫血、粒细胞减少、肠梗阻等)的概率增加,是患者放疗后发生不良事件的独立危险因素。碱性磷酸酶(ALP)是一种磷酸单酯水解酶,在人体肝脏、骨骼、肠等组织中分布较广泛,研究发现ALP对胃癌骨转移的诊断价值高于 CEA、CA-199,并且 ALP 水平与骨转移分级相关[15]。AAPR 是白蛋白与碱性磷酸酶的比值,是一种新型的癌症患者预后指标,在多种恶性肿瘤中已经发现低水平的 AAPR 与患者预后不良相关[16-18]。2021 年,Wang 等[19] 率先探讨了 AAPR 与胃癌患者预后的关系,发现术前 AAPR 水平降低与胃癌患者无病生存期、总生存期缩短有关,AAPR是胃癌患者预后的独立危险因素。该研究还创新性地将AAPR与TNM分期系统联合构建了AAPR-TNM 分期系统,分析后发现新的 AAPR-TNM 分期系统在 DFS 和 OS 预测方面均优于 TNM 分期系统,与陈明干等[20-21] 的研究结果类似。
在肿瘤微环境中,中性粒细胞可以直接产生髓过氧化物酶、中性粒细胞弹性蛋白酶和基质金属蛋白酶等促进肿瘤细胞增殖、迁移、侵袭。还可以募集肿瘤微环境中发挥促肿瘤作用的其他免疫细胞群体、抑制其他免疫细胞向肿瘤微环境聚集,从而促进肿瘤的生长[22]。单核细胞可释放成纤维细胞生长因子、血管内皮生长因子、IL-1、IL-8、TNF-a、 MMP-9、MMP-2 及一氧化氮等促血管生成的分子,促进肿瘤血管新生,为肿瘤进展提供保障。淋巴细胞是人体内免疫系统的重要成分,可以监视、杀灭肿瘤细胞,随着肿瘤发生发展,淋巴细胞耗竭导致肿瘤细胞发生免疫逃逸,机体抗肿瘤能力下降,延缓癌细胞浸润的作用减弱[23]。SIRI由上述3种炎细胞计算得来,是一个新型的炎症评估指标。2016年首次由 Qi等[24] 提出,在接受姑息性化疗的晚期胰腺癌患者中,SIRI 显示出较好的预测价值。近年来,大量临床试验对 SIRI与呼吸系统肿瘤[25]、泌尿系统肿瘤[26]、生殖系统肿瘤[27] 等不同肿瘤患者的相关性进行了探讨。Li等[28] 发现,SIRI是胃癌患者无病生存期的独立预测因子,并与年龄、肿瘤大小、TNM分期、淋巴管和外周浸润密切相关。同时,低 SIRI 的患者可从术后辅助化疗中获益,预后较好。Liu等[29] 在两个独立的队列里研究了SIRI术前、术后的变化对胃癌患者生存期的影响,结果显示,与 SIRI 不变组(增加<50%或减少<50%)比较,术后4~6周SIRI 增加 >50% 患者的术后生存期短,而 SIRI 减少 >50% 的胃癌患者的术后生存期长,表明 SIRI 术前、术后的动态变化与胃癌患者的预后密切相关。
本研究根据 AAPR、SIRI 截断值构建 AAPR-SIRI评分,Cox多因素分析发现,AAPR-SIRI评分是胃癌患者预后的独立危险因素,还发现较高的 AAPR-SIRI评分与高 TNM 分期、较大的肿瘤直径、神经脉管侵犯、生存时间短等相关,说明 AAPR-SIRI 评分升高与胃癌的侵袭性增强相关;AAPR-SIRI 2 分组、1 分组较 0 分组患者的总体生存期短,一方面可能与高评分患者肿瘤直径较大、病理分期较晚等病理特征有关。另一方面,高AAPR-SIRI评分预示着白蛋白水平、淋巴细胞计数降低,ALP 水平、中性粒细胞计数、单核细胞计数升高,反映了机体较差的营养状态及炎症反应,这些变化会促进肿瘤发生发展,影响患者预后。因此,对于高 AAPR-SIRI评分的患者,临床应加强高分组患者的术后密切随访及全程化管理,尽可能提供个体化的综合治疗。
综上所述,本研究认为,术前 AAPR 联合 SIRI 可以评估行根治性切除胃癌患者的预后,与胃癌患者临床病理特征存在相关性,并且具有获取简单、廉价等优点。需要指出的是,本研究存在以下不足:(1)本研究是一个单中心的回顾性研究,且样本量相对较小,可能会对研究结果造成一定的影响,希望以后有多中心大样本的前瞻性研究进一步论证该结论。(2)本研究采用 ROC 曲线法确定了 AAPR、SIRI的截断值,虽然得到了有意义的分析结果,但仍不能确定选取其他截断值是否会更具有临床价值,这仍需要进一步的研究和探讨。各种不足导致本研究的许多偏差,因此,需要进一步开展多中心、前瞻性的研究来证明 AAPR-SIRI 评分的合理性。





