摘要
目的 制备灵芝孢子油-姜黄素纳米乳(GLSO@CUR NEs),探讨其对溃疡性结肠炎(UC)的治疗作用。方法 以吐温80、无水乙醇、灵芝孢子油和姜黄素为主要原料,制备GLSO@CUR NEs。采用透射电镜(TEM) 观察纳米颗粒的形貌尺寸,马尔文粒度分析仪测试粒径及Zeta电位,拉曼光谱表征纳米体系中灵芝孢子油特征化学结构,红外光谱表征纳米体系的化学成键,同时分析其在不同生理条件下的稳定性。建立 5% 葡聚糖硫酸钠 (DSS)诱导的UC小鼠模型,从结肠长度、体质量、疾病活动指数(DAI)、结肠病理学组织改变、肠道屏障功能方面观察 GLSO@CUR NEs对 UC小鼠的治疗作用。结果 GLSO@CUR NEs具有流动性和良好的稳定性,液滴形状,大小均匀。在 DSS 所致的 UC 小鼠模型中,GLSO@CUR NEs 可显著改善结肠损伤,包括缓解身体质量降低、降低 DAI、恢复小鼠结肠长度、改善结肠组织病理学损伤(P< 0.05);还可抑制DSS诱导的肠道肿瘤坏死因子-α(TNF-α) 产生,上调细胞因子白介素-4(IL-4)、白介素-10(IL-10)、转化生长因子-β1(TGF-β1)及分泌型免疫球蛋白A(SIgA) 水平,降低血清 D-乳酸水平(P< 0.05),改善肠道屏障功能。结论 成功制备 GLSO@CUR NEs,其对 DSS 所致的 UC具有明显的治疗作用。
Abstract
Objective Preparation of Ganoderma lucidum spore oil-curcumin nanoemulsions (GLSO@CUR NEs) and explore its therapeutic effect on ulcerative colitis (UC). Methods GLSO@CUR NEs were formulated, consisting of Tween 80, anhydrous ethanol, spore oil and curcumin were developed. The morphology and size of GLSO@CUR NEs were observed by using transmission electron microscope (TEM). Malvern particle size analyzer was used to test nanoparticles size and Zeta potential. The characteristic chemical structure of Ganoderma spore oil in nano systems was analyzed by using Raman spectroscopy. The chemical bonding in NEs was determined by infrared spectroscopy. And the stability of GLSO@CUR NEs was analyzed under different physiological conditions. The protective effect on UC was explored in mice with UC induced by 5% dextran sodium sulfate (DSS). The therapeutic effects of GLSO@CUR NEs on UC mice were observed from several aspects, including colon length, body weight, disease activity index (DAI), colon pathological tissue changes, and intestinal barrier function. Results The developed GLSO@CUR NEs had multiple beneficial properties, including fluidity and excellent stability, and the droplets were uniform in shape and size. In the DSS induced UC mice, GLSO@CUR NEs significantly ameliorated colon injury, including increasing body weight,decreasing the DAI, restoring colon length, and improving histological damage (P< 0.05). In addition, GLSO@CUR NEs improved intestinal barrier function by inhibiting DSS induced TNF- α (tumor necrosis factor-alpha) production, upregulating IL-4 (interleukin-4), IL-10 (interleukin-10), TGF-β1 (transforming growth factor-β1) and SIgA (secretory IgA) levels, reducing serum D-lactate levels (P< 0.05). Conclusion A nanoparticle formulation, GLSO@CUR NEs, was successfully developed and shown to possess therapeutic efficacy against DSS-induced UC.
Keywords
溃疡性结肠炎(UC)是一种慢性、难治性、炎症性肠病,其发病率在全球范围内呈上升趋势[1-2]。 UC发病机制是多因素的,包括基因易感性、上皮屏障缺陷、肠道微生物群紊乱、免疫反应失衡和环境危害[3-4]。研究表明,UC 的发生伴随着小肠功能的显著变化[5]。而葡聚糖硫酸钠(DSS)造成的损伤不仅局限于 UC 动物模型中的结肠部位,还会导致小肠的生化和形态学变化[6]。目前,UC的临床治疗药物主要包括 5-氨基水杨酸类药物、类固醇药物、免疫抑制剂等。5-氨基水杨酸药物是临床中治疗轻、中度 UC 的一线药物,本研究所使用的对照药物柳氮磺胺吡啶是一种常见的 5-氨基水杨酸药物。类固醇药物因副作用风险和缺乏长期使用的疗效评价,不用于维持缓解性治疗[7]。而免疫抑制剂的长期使用可能会导致严重不良反应和并发症。
传统中药灵芝因其多种药用活性而广为人知。研究表明,灵芝可以抑制醋酸性结肠炎大鼠的肠道炎症,减轻黏膜损伤[8]。灵芝孢子油(GLSO)是一种从破壁的灵芝孢子中提取的油性脂质物质,研究报道其可以通过调节皮肤微生物群抑制炎症,加速皮肤伤口愈合,并通过缓解滑膜炎症和中性粒细胞浸润抑制类风湿性关节炎[9-10]。研究表明,从中药姜黄中提取的姜黄素具有抗氧化、抗炎、降脂、抗肿瘤和降血糖等多种药理活性,可以缓解轻中度 UC,改善患者的生活质量[11-13],但其水溶性差、化学不稳定、口服生物利用度有限且渗透性低[14-16]。此外,姜黄素作为 p-糖蛋白的底物,p-糖蛋白将其从肠膜中排出并限制其渗透性[17]。Bilia等[15] 通过制备纳米制剂提高了姜黄素的口服生物利用率。Khursheed 等[18-19] 亦制备出一种以灵芝提取物和益生菌为载体的固体姜黄素自纳米乳递送系统,提高了姜黄的生物利用度。本研究制备了一种新型的灵芝孢子油- 姜黄素纳米乳(GLSO@CUR NEs),并证明了其对 UC的保护作用,以期为UC的治疗提供新思路。
1 材料和方法
1.1 试剂
灵芝孢子油(广州白云山汉方现代药业有限公司,货号18718);吐温80、无水乙醇、姜黄素、DSS和柳氮磺胺吡啶(上海麦克林生化科技股份有限公司,货号 T796772、E809056、C805205、D806297、 S838221);HE 染液(武汉赛维尔生物科技有限公司,货号G1005);二甲苯(国药集团化学试剂有限公司,货号 10023418);IL-2、IL-4、IL-10、TGF-β1 和 D-乳酸 ELISA 试剂盒(睿信生物科技有限公司,货号 RX203061M、RX203051M、RX203075M、RX202402 M、JRX000036);TNF-α ELISA试剂盒(武汉博士德生物工程有限公司,货号 EK0527);分泌型免疫球蛋白 A(SIgA)ELISA 试剂盒(上海酶联生物科技有限公司,货号ml001917)。
1.2 仪器
H-7650型TEM透射电子显微镜(日本Hitachi), Nano ZS 型粒度仪(英国 Malvern),Equinox 55 型傅立叶变换红外光谱(美国 Bruker),LaBRAM HR Evolution 拉曼光谱仪(日本 Horiba),IX73P2F 型倒置光学显微镜(日本 Olympus),epoch2 型酶联免疫检测仪(美国Bio Tek),JJ-12J型脱水机(武汉俊杰电子有限公司),JB-P5 型包埋机(武汉俊杰电子有限公司),RM2016 型病理切片机(上海莱卡仪器有限公司),KD-P 型组织摊片机(科迪仪器设备有限公司),A16K-R 高速冷冻离心机(湖南安君研仪器有限公司)。
1.3 动物
雄性无特定病原体(SPF级)C57BL/6小鼠(8周龄)购于北京华阜康生物科技股份有限公司,饲养于广东医科大学实验动物中心 SPF级屏障实验室,光照 12 h/12 h 明暗交替。本研究动物实验遵循 ARRIVE(animal research: reporting in vivo experi‐ ments)指南,并通过广东医科大学动物实验伦理委员会批准(编号GDY2104029)。
1.4 GLSO@CUR NEs的合成
将 3 mL 吐温 80 和 0.15 mL 无水乙醇在室温下搅拌 5 min,400 r/min 进行物理交联形成复合凝聚膜。随后将5 mL GLSO缓慢注入复合凝聚膜中,室温下 800 r/min 搅拌 5 min,去离子水定容至 50 mL,形成 GLSO 初乳混合物,分别将不同质量的姜黄素 (10、20、40 mg)溶解在无水乙醇中,将姜黄素溶液加入到 GLSO 初乳混合物中,搅拌 15 min 形成灵芝孢子油和姜黄素的初乳混合物,随后转移到高压均质机中均质,最后形成GLSO@CUR NEs。
1.5 GLSO@CUR NEs的表征
将纳米乳滴在覆盖有硝化纤维素膜的铜网板上,干燥后使用 1% 磷钨酸溶液染色。然后采用 TEM观察纳米颗粒等形貌尺寸;马尔文粒度分析仪检测纳米乳液的粒径和 Zeta电位(Zeta电位用于评价纳米乳体系的稳定性);拉曼光谱分析纳米颗粒的特征化学结构;红外光谱对纳米乳液化学成键进行表征。在蒸馏水和人血清不同条件下,观察纳米乳液在不同生理条件下的稳定性。
1.6 实验分组和给药
将 32 只 C57BL/6 雄性小鼠随机分为 4 组,每组 8只。对照组小鼠自由饮用去离子水。DSS组小鼠自由饮用去离子水制备的 5% DSS 7 d 后,饮用去离子水 2 d。GLSO@CUR NEs 组给予小鼠 0.8 g/L GLSO@CUR NEs(每只小鼠 200 μL,灌胃给药)和 5% DSS(自由饮用),连续 7 d,然后再单独给予 0.8 g/LGLSO@CUR NEs 2 d。柳氮磺胺吡啶组给予小鼠50 g/L柳氮磺胺吡啶(每只小鼠200 μL,腹腔注射)和 5% DSS(自由饮用),连续 7 d,然后再单独给予柳氮磺胺吡啶2 d。
1.7 疾病活动指数(DAI)分析
每天记录小鼠身体质量、腹泻和出血情况,同时 DAI进行评分,将每只小鼠的所有得分相加得到 DAI总分[20]。
1.8 结肠组织病理学观察
结肠组织室温浸泡于 4%(w/v)多聚甲醛中过夜,经梯度乙醇脱水,石蜡包埋,连续切片(每片 4 μm),行苏木精和伊红染色,最后脱水封片。使用光学显微镜观察结肠切片,并进行组织病理学评分[20]。
1.9 小肠组织中分泌型免疫球蛋白 A(SIgA)水平的测定
将小肠从胃十二指肠连接处到回肠-升结肠连接处迅速取出。用预冷 PBS缓冲液洗涤小肠,置于含有胰蛋白酶抑制剂、50 mmol/L EDTA的PBS溶液中。纵向切开肠组织并使用 PBS缓冲液清洗,使小肠内容物溶解在PBS溶液中,在4 °C,4 500 r/min 离心20 min,收集上清液。采用SlgA酶联免疫吸附测定试剂盒检测SIgA水平。
1.10 血清中D-乳酸水平的测定
采集血液,在 4 o C 下,5 600 r/min 离心后取血清。采用ELISA试剂盒检查血清中D-乳酸浓度。
1.11 小肠细胞因子水平的测定
剪取接近胃部幽门处 2~3 cm 一段小肠组织,称取 0.2 g 小肠组织样本,置于蛋白裂解液中,使用组织匀浆器匀浆完全,4 o C、4 500 r/min离心10 min,收集上清液。ELISA 试剂盒检测上清液中肿瘤坏死因子-α(TNF-α)、白介素-4(IL-4)、白介素-10(IL-10)、转化生长因子-β1(TGF-β1)蛋白水平。
1.12 统计学处理
使用 GraphPad Prism 7 软件对数据进行分析,所有数据以表示,采用One-way ANOVA分析多组间差异,LSD检验用于组间两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 GLSO@CUR NEs的合成与表征
2.1.1 GLSO@CUR NEs 的外观、微观形态、粒径和电位
GLSO@CUR NEs纳米体系总体为黄色,且姜黄素质量浓度越高,纳米体系的颜色越深(图1A)。 TEM 显示,纳米乳液滴具有均匀的形状和大小(图1B)。马尔文粒度分析仪检测到 GLSO@CUR NEs 是约 70 nm 的球形纳米颗粒,随着姜黄素质量浓度的增加,NEs的粒径没有明显变化(图1C)。姜黄素的 Zeta 电位约为-7.63 mV,GLSO 的 Zeta 电位约为-5.17 mV,均质后的 GLSO@CUR NEs 纳米乳 Zeta 电位约为-11.43 mV,见图1D。
2.1.2 GLSO@CUR NEs 的稳定性分析
对 GLSO@CUR NEs 纳米乳体系的稳定性进行监测和分析,结果见图2。在 144 h 的监测期间, GLSO@CUR NEs 的粒径保持在 70~100 nm,变化不明显。与人血清共孵育 144~360 h,纳米粒度变化相对明显,颗粒大小从 100 nm 增大到 170 nm 左右。因此,GLSO@CUR NEs 在水环境和生理环境中均能在6 d内保持相对稳定。
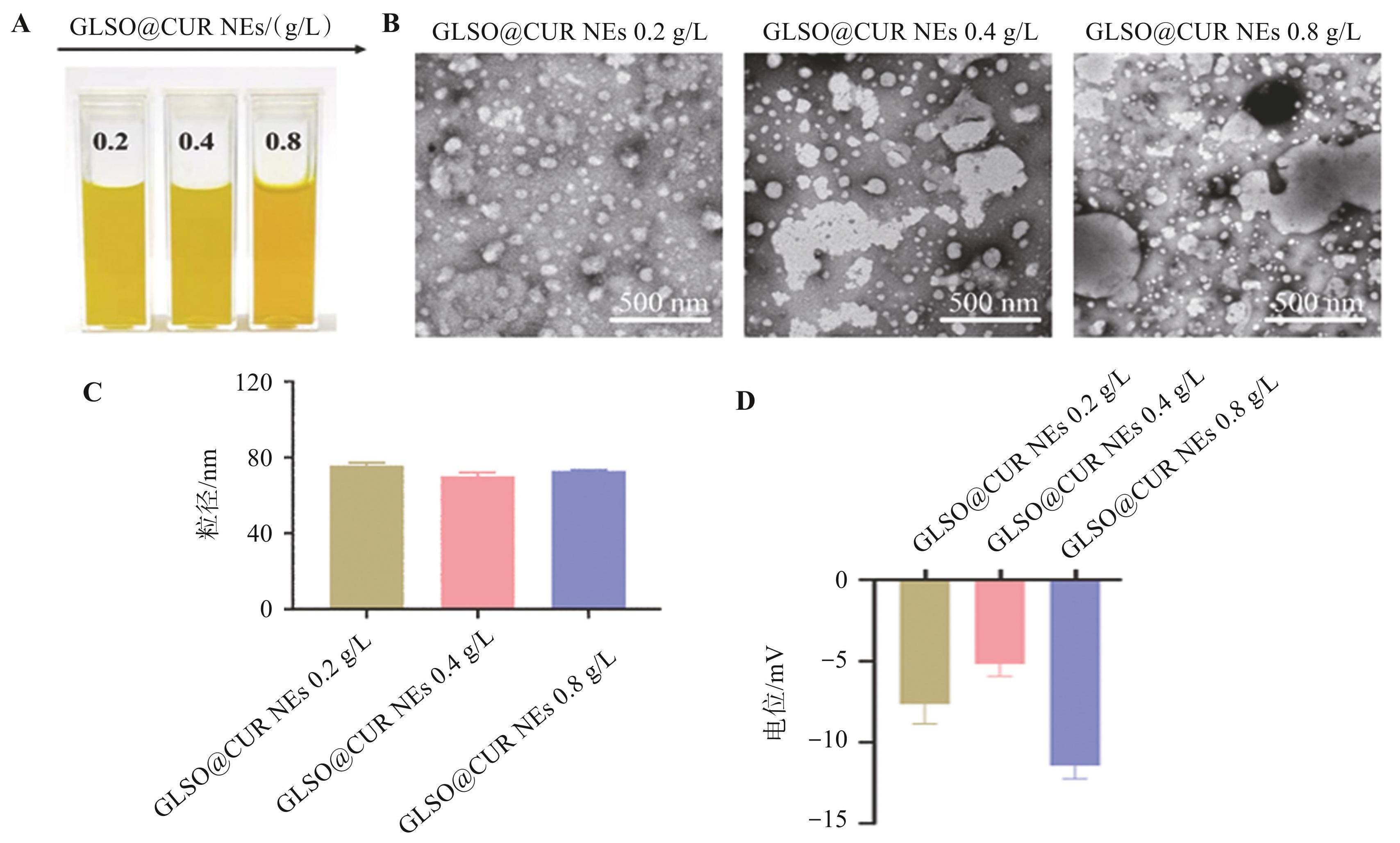
图1GLSO@CUR NEs的外观、微观形态、粒径和电位
A.纳米乳颜色;B. TEM图片;C.粒径图;D. Zeta电位图。
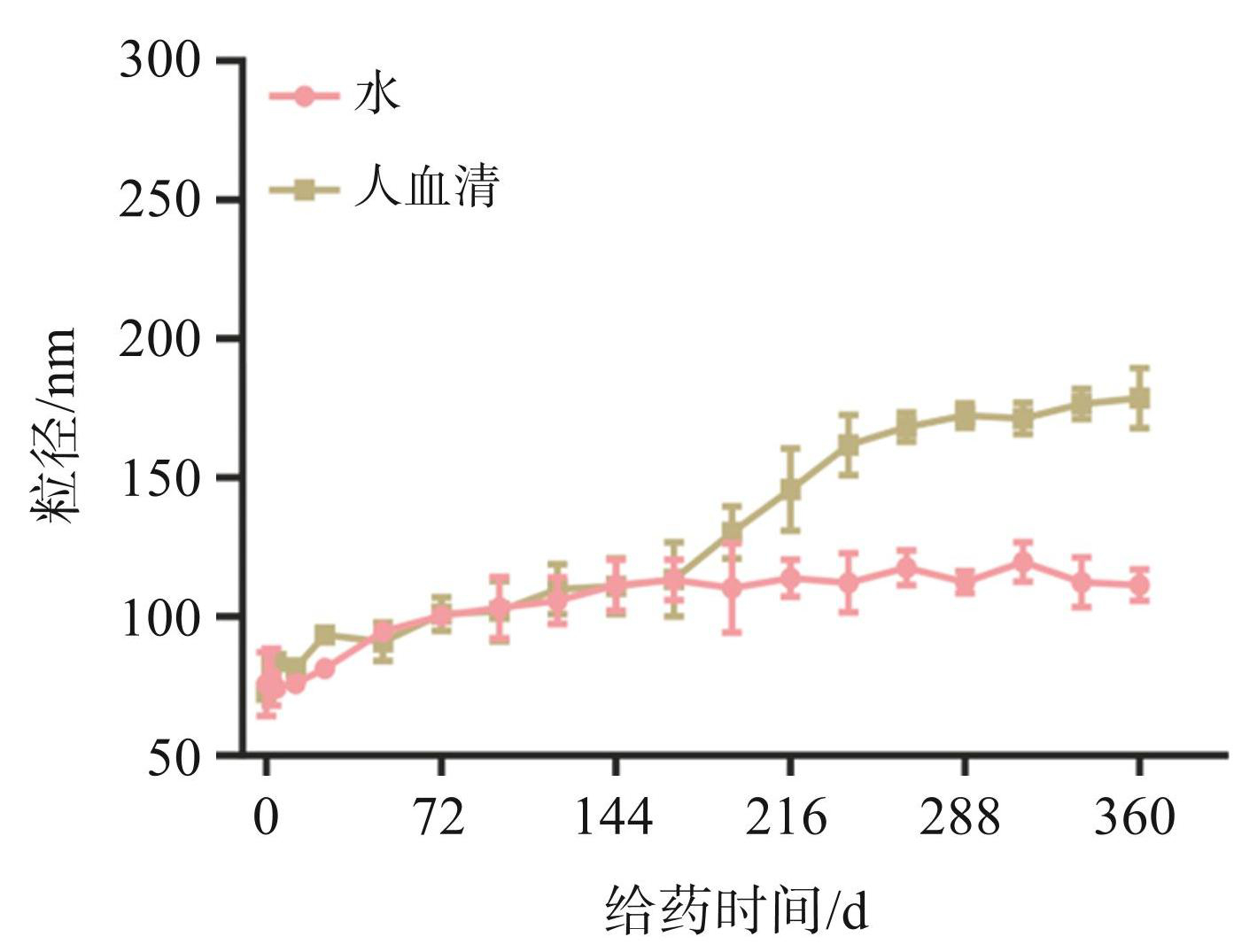
图2GLSO@CUR NEs的稳定性分析
2.2 GLSO@CUR NEs 改善 DSS 所致的 UC 小鼠结肠损伤
2.2.1 GLSO@CUR NEs 对 UC 小鼠身体质量的影响
使用柳氮磺胺吡啶作为阳性对照药物,GLSO@CUR NEs 治疗 UC 的疗效如图3所示,5% DSS 诱导结肠炎的小鼠大约在 4 d 后开始出现身体质量减轻,而服用GLSO@CUR NEs的小鼠身体质量减轻症状缓解(P< 0.001)。
2.2.2 GLSO@CUR NEs 对 DSS 诱导 UC 小鼠 DAI评分的影响
DAI 常用于评估结肠炎的严重程度, DAI得分越高,疾病越严重。DAI评分结果表明,与 DSS 组相比,GLSO@CUR NEs 和柳氮磺胺吡啶组小鼠的DAI显著降低(P< 0.001或0.01),见图4。

图3GLSO@CUR NEs对UC小鼠体质量的影响
与空白对照组比较:***P<0.001;与DSS组比较:###P<0.001。
2.2.3 GLSO@CUR NEs 对 UC 小鼠结肠长度的影响
GLSO@CUR NEs 组较 DSS 组结肠长度明显增加(P< 0.05),见图5。
2.2.4 GLSO@CUR NEs 对 UC 小鼠结肠病理组织学的影响
在 DSS 组小鼠中,结肠组织出现明显的隐窝丢失,黏膜溃疡,杯状细胞数量减少,炎症细胞浸润。而GLSO@CUR NEs和柳氮磺胺吡啶处理小鼠后结肠组织的组织学损伤明显减轻(P<0.01)。见图6。
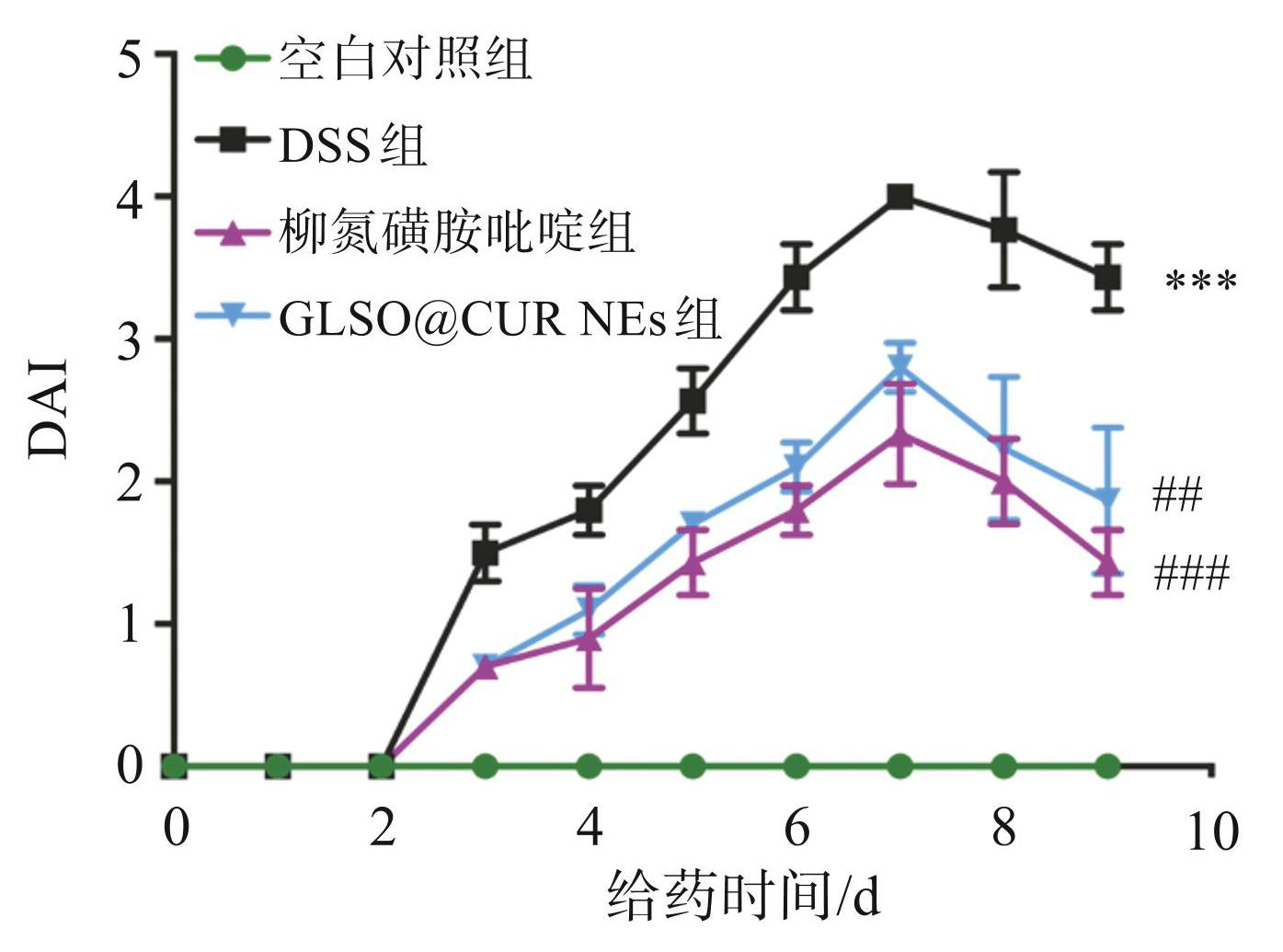
图4GLSO@CUR NEs对DSS诱导UC小鼠DA1评分的影响
与空白对照组比较:***P<0.001;与 DSS 组比较: ##P<0.01,###P<0.001。

图5GLSO@CUR NEs对UC小鼠结肠长度的影响
A.各组结肠图;B.结肠长度统计图(* P<0.05,***P<0.001)。
2.3 GLSO@CUR NEs 改善 DSS 诱导的 UC 小鼠肠道屏障损伤
2.3.1 GLSO@CUR NEs对UC小鼠炎症反应的影响
ELISA 法检测小鼠小肠组织中细胞因子水平的变化,如图7所示,GLSO@CUR NEs处理小鼠后,肠道组织中促炎因子TNF-α水平明显低于单独DSS处理组(P<0.001)。此外,与 DSS 组相比,GLSO@CUR NEs 组 IL-10、IL-4 和 TGF-b1 的表达增加(P<0.01 或0.05)。结果表明GLSO@CUR NEs可调控DSS诱导 UC小肠中细胞因子水平,提示 GLSO@CUR NEs可抑制DSS所致小鼠肠道屏障损伤。

图6GLSO@CUR NEs对UC小鼠结肠病理组织学的影响
A. H&E 染色图(× 200);B. 组织学评分(蓝色箭头表示隐窝,绿色箭头表示溃疡,黑色箭头表示杯状细胞,红色线表示黏膜区域,**P<0.01,***P<0.001)。
2.3.2 GLSO@CUR NEs 对 UC 小鼠中 D-乳酸和 SIgA 水平的影响
如图8A 所示,GLSO@CUR NEs 可显著降低 DSS 诱导的 D-乳酸水平升高(P<0.05)。GLSO@CUR NEs 显著上调 DSS 诱导的小肠组织中SIgA的产生(P<0.001),见图8B。
3 讨论
纳米乳是一种热力学稳定的胶体分散体系,由两种不混溶的液体与乳化剂混合而成[21]。纳米给药系统具有多种优点,包括更好的药物治疗效果、更小的副作用和更高的生物利用度[22]。纳米乳不仅能提高姜黄素在水中的溶解度、生物利用度等,而且能提高姜黄素的抗氧化、抗癌及抗炎作用[23-24]。因此,纳米乳剂被认为是一种非常有前途的药物载体。研究证明,纳米药物能够缩短结肠长度、缓解身体质量降低 DAI、减少结肠组织损伤和抑制炎症因子的产生,是治疗 UC 的一种很有前景的方法[25-27]。

图7GLSO@CUR NEs对UC小鼠炎症反应的影响
A. TNF-α蛋白表达;B. IL-4蛋白表达;C. IL-10蛋白表达;D. TGF-b1蛋白表达;* P<0.05,**P<0.01,***P<0.001。
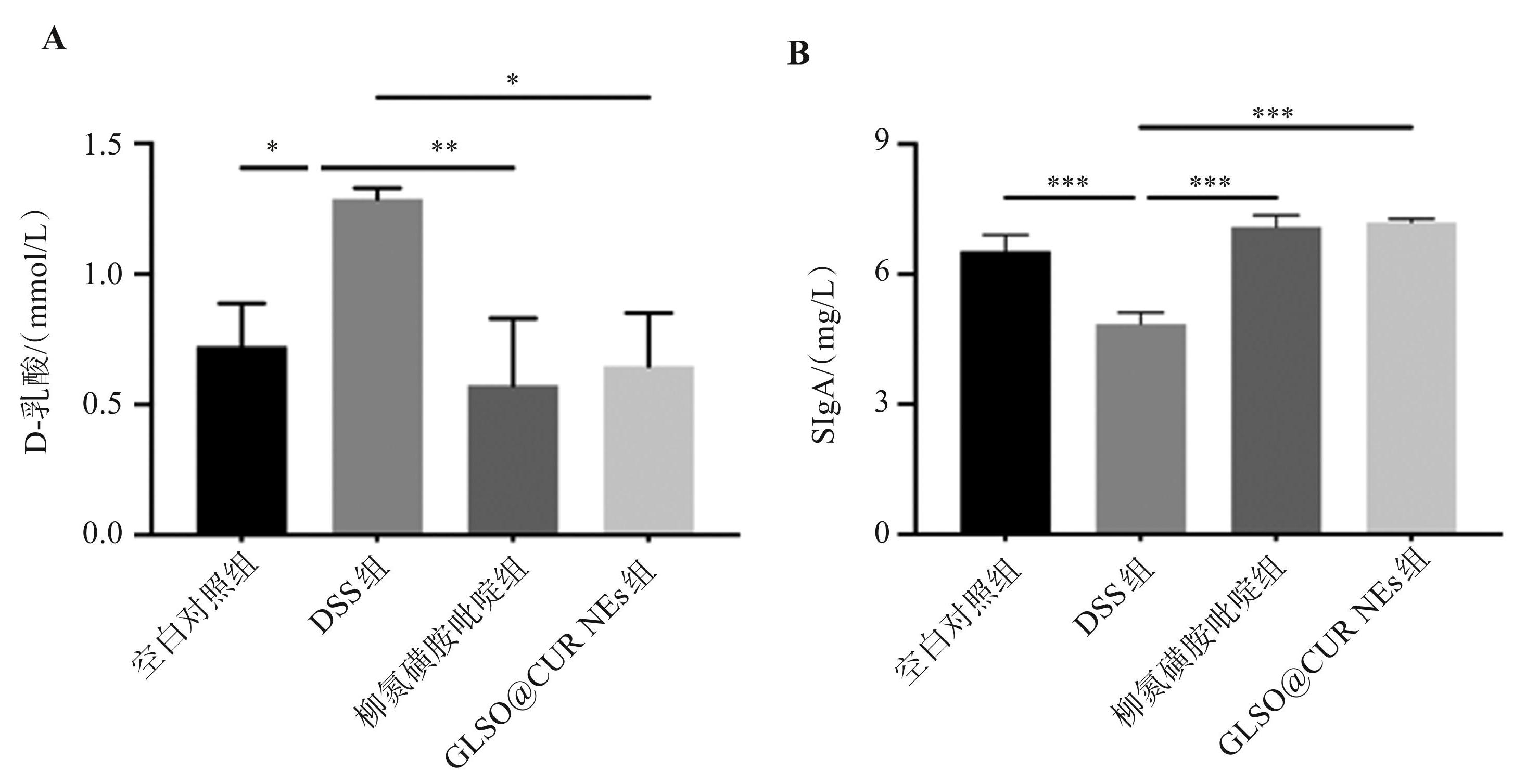
图8GLSO@CUR NEs对UC小鼠中D-乳酸和SIgA水平的影响
A. D-乳酸蛋白表达;B. SIgA蛋白表达;* P<0.05,**P<0.01,***P<0.001。
本研究合成了由吐温 80、无水乙醇、灵芝孢子油和姜黄素组成的孢子油-姜黄素纳米乳,并对其进行了表征。液滴尺寸是表征纳米成型性能的重要参数。由液滴大小测定可知GLSO@CUR NEs的液滴大小约为 70 nm。GLSO@CUR NEs的 TEM 图像显示其具有均匀的形状和大小。研究发现,评价纳米级给药体系的稀释稳定性和热力学稳定性具有重要的意义[25]。本研究结果表明 GLSO@CUR NEs在水环境或生理环境中 6 d 内均具有较好的稳定性,能够满足后续药物开发和应用的要求。
基于上述结果,研究进一步评估了GLSO@CUR NEs对UC的保护作用,发现GLSO@CUR NEs可以有效缓解DSS诱导的结肠炎小鼠身体质量的减轻、 DAI评分的升高和结肠长度的缩短。此外,组织病理学观察进一步证实了 GLSO@CUR NEs 对 UC 的治疗作用:GLSO@CUR NEs 可显著改善黏膜损伤和炎症细胞浸润。综上,GLSO@CUR NEs 可以通过抑制结肠组织炎症防治DSS诱导的UC。
肠道屏障的破坏导致肠道微生物易位,促进促炎细胞因子的产生,从而促进黏膜免疫系统的高度激活,加重炎症性肠病的炎症反应[28-29]。细胞因子 IL-10、IL-4和TGF-b1是免疫抑制和免疫调节因子,可有效抑制促炎细胞因子的合成和抗原递呈,从而减轻炎症反应[30-32]。研究报道,在 UC 模型中,肠道免疫系统关键信号 IL-10、IL-4 和 TGF-b1 细胞因子水平升高可抑制肠道黏膜的炎症和损伤[33-34]。此外,TNF-α 等细胞因子的不平衡释放会加重炎症反应。因为 TNF-α 水平在 DSS 诱导的 UC 中显著升高,所以抑制 TNF-α的产生可以有效改善溃疡性结肠炎[35-36]。本研究中,GLSO@CUR NEs能够显著抑制 5% DSS 诱导的 TNF-α 蛋白表达,并上调免疫调节介质 IL-10、IL-4 和 TGF-b1 的产生。上述结果提示GLSO@CUR NEs对DSS诱导的结肠炎小鼠具有保护作用,其机制可能是通过降低促炎细胞因子和增加抗炎细胞因子重塑肠道屏障结构。
肠上皮细胞与先天免疫系统形成的肠屏障维持着肠黏膜腔内容物的平衡[37-38]。一旦肠屏障被破坏,D-乳酸就会通过受损的屏障进入血液,因此 D-乳酸是评价肠屏障损伤程度的一个重要指标。本研究发现UC小鼠肠道中活性消化蛋白酶D-乳酸升高可破坏肠道组织结构,增加肠道通透性,结果证明 GLSO@CUR NEs 可以通过抑制 DSS 引起的 D-乳酸水平升高保护肠道屏障。
SIgA是肠黏膜浆细胞分泌的一种免疫球蛋白,是肠黏膜的第一道防线,能中和病毒、细菌等有害抗原,在局部抗感染作用中起关键作用[39-41]。有研究报道,DSS 可抑制肠道 SIgA 的分泌,从而干扰免疫调节,加重肠黏膜损伤[42]。本研究结果同样表明, DSS处理小鼠的肠道SIgA水平低于空白对照组;给予 GLSO@CUR NEs后,小鼠肠道 SIgA含量显著高于 UC 小鼠,表明 GLSO@CUR NEs 可上调小鼠肠黏膜SIgA的分泌。
综上所述,本研究成功合成了 GLSO@CUR NEs,并对 GLSO@CUR NEs在小鼠体内的抗 UC作用进行了评价,结果表明 GLSO@CUR NEs 对小鼠 UC具有明显的抗炎作用,可以减轻结肠损伤,保护肠道屏障功能。本研究为 GLSO@CUR NEs 治疗 UC的临床应用提供了实验基础。







