摘要
目的 探究羊栖菜多糖的脱色工艺及其抗氧化活性。方法 采用活性炭、过氧化氢、D101型大孔树脂和AB-8型大孔树脂4种脱色方法对羊栖菜多糖进行脱色。在单因素试验的基础上,以多糖保留率和脱蛋白率为指标,通过响应面法优化羊栖菜多糖的脱色工艺,评价脱色前后羊栖菜多糖的体外抗氧化活性。结果 对比4种脱色方法,选择脱色效果较优的 AB-8型大孔树脂脱色法,通过响应面试验设计得出 AB-8型大孔树脂脱色法的最佳脱色工艺条件为:树脂添加量为10%,多糖溶液pH为7,脱色时间为2 h,脱色温度为30 ℃。在此条件下,多糖保留率为 72.60%,脱蛋白率为 69.27%。体外抗氧化活性结果显示,脱色后的羊栖菜多糖对 1,1-二苯基-2-三硝基苯肼 (DPPH)自由基和羟基自由基的最大清除率分别达到 71.32% 和 78.95%。羊栖菜多糖对 DPPH 自由基和羟基自由基的清除能力弱于抗坏血酸(P<0.05))结论 AB-8型大孔树脂脱色法对羊栖菜多糖的脱色效果优于其他3种脱色方法,脱色前后羊栖菜多糖均具有一定的抗氧化活性。
Abstract
Objective To study the decolorization process of Sargassum fusiforme polysaccharide and its antioxidant activity. Methods Four decolorization methods, including activated carbon, hydrogen peroxide, D101 macroporous resin and AB-8 macroporous resin, were employed to decolorize the Sargassum fusiforme polysaccharide. On the basis of single-factor experiments, the decolorization rate and polysaccharide retention rate were used as the indexes to optimize the decolorization process of Sargassum fusiforme polysaccharide using response surface methodology. Furthermore, the in vitro antioxidant activities of Sargassum fusiforme polysaccharide were evaluated both before and after decolorization. Results Upon comparing the four decolorization methods, the AB-8 macroporous resin method, which demonstrated the best decolorization effect, was selected. The optimal decolorization process conditions for this method were obtained through the response surface test design as follows: the resin addition was 10%, the polysaccharide solution pH was 7, the decolorization time was 2 h, and the decolorization temperature was 30 ℃ . Under these conditions, the polysaccharide retention rate was 72.60%, and the deproteinization rate was 69.27%. The results of the in vitro antioxidant activity demonstrated that the maximum scavenging rates of DPPH radicals and hydroxyl radicals from the Sargassum fusiforme polysaccharide after decolorization could reach 71.32% and 78.95%, respectively. The scavenging ability of Fargesia fasciata polysaccharides on DPPH free radicals and hydroxyl free radicals was weaker than that of ascorbic acid (P<0.05). Conclusion The decoloration effect of the AB-8 macroporous resin decolorization method on Sargassum fusiforme polysaccharide was superior to that of the other three decolorization methods, and the Sargassum fusiforme polysaccharides before and after decolorization exhibited moderate antioxidant activities, which can be developed and utilized as natural antioxidants.
羊栖菜(Sargassum fusiforme)为马尾藻科马尾藻属的重要经济海藻,不仅具有药用价值,而且在食用方面也有广泛的应用[1-3]。研究表明,多糖为羊栖菜的主要活性成分之一,具有良好的抗菌、抗炎、抗肿瘤、抗病毒和抗骨质疏松等药理活性[4]。
目前,羊栖菜多糖的提取已有相关报道。但在多糖的提取过程中,往往会混有大量的蛋白质、水溶性色素等杂质。这些杂质的存在会使多糖的颜色加深,影响其纯度,并对多糖的理化性质、药理活性以及多糖的结构解析等方面的研究造成影响,因此有必要对多糖进行脱色处理[5]。现有的多糖脱色方法主要包括化学法和物理法[6]。其中,化学法主要是利用物质的强氧化性来破坏杂质的结构而使其脱色,如过氧化氢等,但该方法容易破坏多糖的结构和功能[7]。而物理法则是利用物质的吸附能力吸附杂质从而达到脱色效果,目前常用的吸附剂主要有活性炭和大孔树脂等[8]。其中活性炭孔径较小,对分子量较大的杂质吸附困难,且脱色耗时长、效率低[9]。而大孔树脂对杂质的吸附作用强,且脱色过程温和不会对多糖的结构造成破坏,再生后还可重复使用,是目前多糖脱色的最常用的方法之一[10]。然而,目前对于羊栖菜多糖的脱色工艺研究却鲜有报道。周峙苗等[11] 研究发现,利用过氧化氢 7%、乙醇 25%、乙酸酐 10% 和醋酸 1% 可对羊栖菜精粉进行脱腥、脱色处理。另外,研究还表明,羊栖菜多糖具有良好的清除 1,1-二苯基-2-三硝基苯肼 (DPPH)自由基、羟基自由基、超氧阴离子和 2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS +)自由基活性[12-13]。本研究以多糖保留率和脱蛋白率为指标,比较活性炭、过氧化氢、D101 型大孔树脂和 AB-8 型大孔树脂 4 种脱色方法对羊栖菜多糖的脱色效果,并在此基础上,采用响应面法优化脱色工艺,测定脱色前后的羊栖菜多糖的抗氧化活性,以期为羊栖菜多糖的进一步开发和利用提供理论基础和科学依据。
1 材料和方法
1.1 材料与试剂
羊栖菜,市售;颗粒状活性炭、浓硫酸、苯酚:国药集团化学试剂有限公司;AB-8 型大孔树脂:上海江莱生物科技有限公司;D101 型大孔树脂、磷酸氢二钾、磷酸二氢钾、冰醋酸、DPPH、水杨酸、抗坏血酸、硫酸亚铁:上海麦克林生化科技有限公司;3% 过氧化氢溶液:山东利尔康科技有限公司;葡萄糖标准品:扬州博睿糖生物技术有限公司;细胞周期与凋亡检测试剂盒:碧云天。
1.2 仪器与设备
ME104E/02 型电子天平:梅特勒-托利多仪器 (上海)有限公司,JY92-IIDN 型中药粉碎机、RE-5299 型旋转蒸发仪:上海精其设备有限公司, XHDHG-系列电热恒温鼓风干燥箱:上海霄汉实业发展有限公司,DF-101S型数显恒温水浴锅:巩义市予华仪器有限责任公司,MRIEPOCHOS-ES型酶标仪:美国宝特仪器有限公司,IRAffinity-1S傅里叶变换红外光谱仪:岛津中国有限公司。
1.3 方法
1.3.1 羊栖菜脱色工艺流程
干燥羊栖菜粉碎→ 过筛→采用水提醇沉法得到羊栖菜粗多糖→磷酸盐缓冲溶液溶解羊栖菜粗多糖→抽滤→羊栖菜多糖提取液→采用不同脱色方法进行试验(活性炭、过氧化氢、D101型大孔树脂和AB-8型大孔树脂)→ 羊栖菜多糖脱色液。
1.3.2 多糖保留率的测定
采用硫酸-苯酚法[14] 测定多糖的含量。吸取脱色前后的样品溶液,于 490 nm处测定吸光度,并代入标准曲线中计算脱色前后样品溶液中的多糖质量浓度,再乘以溶液体积得到其多糖质量。根据下面公式计算多糖保留率(Y1)。
1.3.3 脱蛋白率的测定
采用二辛可宁酸(BCA)法[15] 测定蛋白质的含量。吸取脱色前后的样品溶液,于 562 nm 处测定吸光度,并代入标准曲线中计算脱色前后样品溶液中的蛋白质质量浓度,再乘以溶液体积得到其蛋白质质量。根据下面公式计算脱蛋白率(Y2)。
1.3.4 多糖脱色
称取羊栖菜多糖冻干粉 2.0 g,用 0.4 moL/L的磷酸盐缓冲溶液溶解并定容至250 mL 容量瓶,得到质量浓度8.0 g/L样品溶液。(1)活性炭脱色法。取 5 mL 样品溶液,加入 1.5% 的活性炭粉末,在脱色 pH 为 7.0、脱色温度为 60℃的条件下脱色1.5 h,过滤。计算脱色后的样品溶液中的多糖保留率和脱蛋白率。(2)过氧化氢脱色法。取 5 mL 样品溶液,加入2.0%的过氧化氢,在脱色pH为7.0、脱色温度为 60℃的条件下脱色 1.5 h,过滤。随后,计算脱色后的样品溶液中的多糖保留率和脱蛋白率。 (3)D101型大孔树脂脱色法。取5 mL样品溶液,加入 15.0% 的 D101 型大孔树脂,在脱色 pH 为 7.0、脱色温度为 60℃的条件下脱色 1.5 h,过滤。计算脱色后的样品溶液中的多糖保留率和脱蛋白率。(4) AB-8 型大孔树脂脱色法。取 5 mL 样品溶液,加入 10.0% 的 AB-8 型大孔树脂,在脱色 pH 为 7.0、脱色温度为 60℃的条件下脱色 1.5 h,过滤。计算脱色后的样品溶液中的多糖保留率和脱蛋白率。
1.3.5 AB-8型大孔树脂脱色法的单因素试验
(1) 树脂添加量对脱色效果的影响。取 5 份 5 mL 样品溶液于试管中,加入树脂添加量分别为 5%、10%、 15%、20%、25% 的 AB-8型大孔树脂。在脱色 pH 为 7.0、脱色温度为30℃的条件下脱色2.0 h,过滤除去大孔树脂,测定脱色后吸光度 A490 nm和 A562 nm,计算羊栖菜多糖保留率和脱蛋白率。按上述步骤操作重复 3 次。(2)pH 值对脱色效果的影响。取 5 份 5 mL样品溶液于试管中,加入树脂添加量为10%的 AB-8 型大孔树脂。在脱色 pH 分别为 6.0、6.5、7.0、 7.5、8.0,脱色温度为 30℃的条件下脱色 2.0 h,过滤除去大孔树脂,测定脱色后吸光度 A490 nm和 A562 nm,计算羊栖菜多糖保留率和脱蛋白率。按上述步骤操作重复3次。(3)脱色时间对脱色效果的影响。取 5 份 5 mL 样品溶液于试管中,加入树脂添加量为 10%的AB-8型大孔树脂。在脱色pH为7.0、脱色温度为 30℃的条件下分别脱色 0.5、1.0、1.5、2.0、2.5 h,过滤除去大孔树脂,测定脱色后吸光度 A490 nm和A562 nm,计算羊栖菜多糖保留率和脱蛋白率。按上述步骤操作重复 3 次。(4)脱色温度对脱色效果的影响。取5份5 mL样品溶液于试管中,加入树脂添加量为10%的AB-8型大孔树脂。在脱色pH为7.0、脱色温度分别为 20、25、30、35、40℃的条件下脱色 2.0 h,过滤除去大孔树脂,测定脱色后吸光度 A490 nm 和 A562 nm,计算羊栖菜多糖保留率和脱蛋白率。按上述步骤操作重复3次。
1.3.6 响应面试验设计
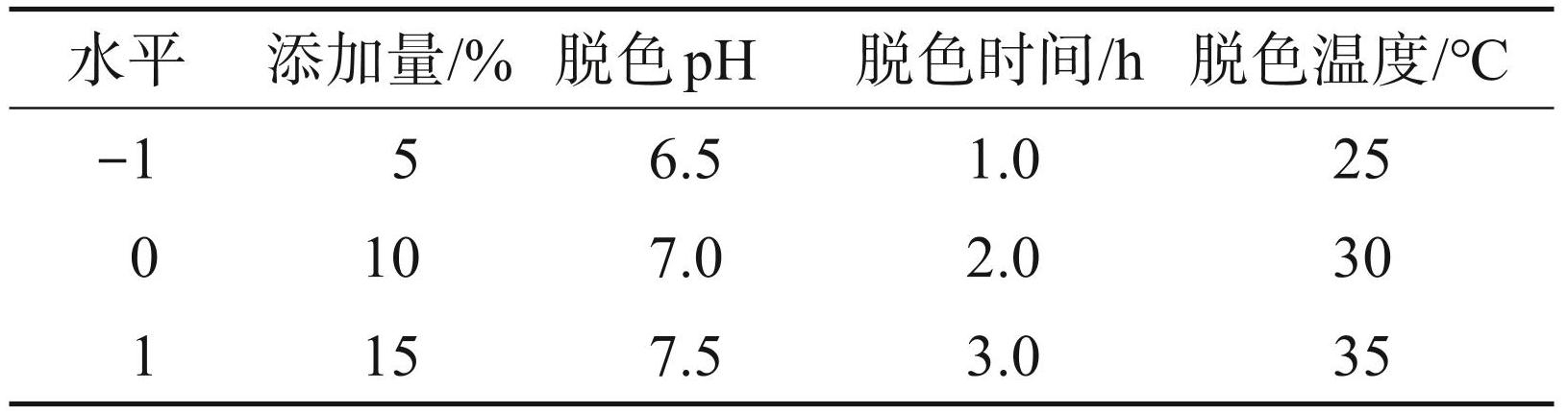
在单因素试验的基础上,确定各因素的最佳水平范围。采用响应面中心组合试验设计,以树脂添加量(A)、脱色 pH(B)、脱色时间(C)、脱色温度(D)为自变量,以多糖保留率和脱蛋白率为响应值,进行 4 因素 3 水平的响应面优化设计。其响应面试验因素及水平见表1。响应面越陡峭,表明研究因素对结果的影响程度越大[16]。等高线图呈椭圆形,则表明各因素之间的交互作用影响显著,呈圆形则说明交互作用影响不显著[17]。
表1响应面设计因素水平表
1.3.7 样品脱色前后的抗氧化活性测定
称取适量脱色前后的羊栖菜多糖,配制成质量浓度分别为 1.0、2.0、3.0、4.0、5.0 g/L的多糖溶液,并以抗坏血酸溶液作为阳性对照,评价羊栖菜多糖脱色前后的抗氧化活性。(1)DPPH自由基清除能力测定。参照文献[18] 方法测定脱色前后的羊栖菜多糖对DPPH自由基的清除能力:吸取 2 mL 不同质量浓度的样品溶液,分别加入 10 mL 离心管中,随后分别加入 2 mL 0.2 mmol/L DPPH无水乙醇溶液,振荡混匀后,置室温下避光反应30 min,酶标仪测定517 nm处的吸光度。以抗坏血酸作为阳性对照,各组设置3个重复。根据下面公式计算DPPH自由基的清除率(Y3)。
(2)羟基自由基清除能力测定。参照文献[19] 方法测定脱色前后的羊栖菜多糖对羟基自由基的清除能力:吸取 1 mL 不同质量浓度的样品溶液,分别加入10 mL离心管中,随后分别加入1 mL 9 mmol/L 硫酸亚铁溶液和 1 mL 9 mmoL/L 水杨酸-乙醇溶液,振荡混匀后,又加入1 mL 8.8 mmoL/L过氧化氢溶液启动反应,在 37℃水浴下反应 30 min,然后冷却至室温,酶标仪测定510 nm处的吸光度。以抗坏血酸作为阳性对照,各组设置 3 个重复。根据下面公式计算羟基自由基的清除率(Y4)。
1.3.8 红外光谱分析
称取脱色前后的羊栖菜多糖各 2 mg,与干燥的溴化钾粉末(200 mg)混合,研磨后分别压成厚度为 1 mm 的颗粒,随后使用傅里叶变换红外光谱仪在400~4 000 cm-1 对样品进行扫描和分析。
1.3.9 CCK-8 细胞毒性实验
C3H10 细胞以 2 × 103 /孔的密度接种于 96 孔板中培养,分别将不同质量浓度的脱色前后的羊栖菜多糖(1.0、2.0、3.0、4.0、 5.0 g/L)加入不同孔中,划分不同的实验组,并设置不加化合物的孔作为空白对照组。将 96 孔板置于培养箱中继续培养48 h,加入CCK-8溶液,孵育1 h。随后,采用多功能酶标仪于450 nm处测定各孔的吸光度值(A),分析细胞活力的变化。
1.4 统计学处理
采用 Graphpad prism 8.0 数据分析软件对数据进行单因素方差分析,使用 Origin 2021软件对数据进行统计分析并绘制图表,使用Design Expert 13.0.1 进行响应面分析。P<0.05为差异有统计学意义。
2 结果
2.1 不同脱色方法对羊栖菜脱色效果的影响
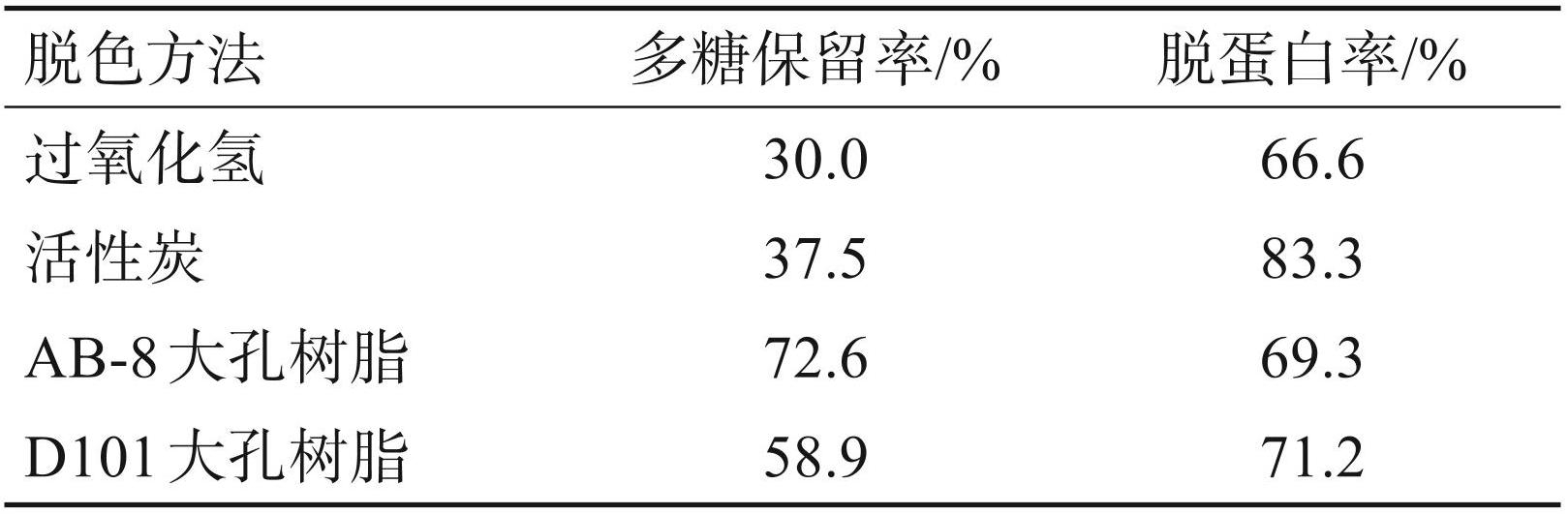
由表2可知,以下 4 种脱色方法对于羊栖菜多糖均有一定的脱色效果。羊栖菜多糖保留率由高到低为:AB-8型大孔树脂>D101型大孔树脂>活性炭 >过氧化氢。脱蛋白率从高到低为:活性炭 >D101 型大孔树脂 >AB-8 型大孔树脂 >过氧化氢。综合考虑,后续试验进行 AB-8 型大孔树脂脱色法的工艺优化。
表24种脱色方法的脱色效果的比较
2.2 AB-8型大孔树脂脱色法的单因素试验
2.2.1 树脂添加量对脱色效果的影响
由图1可知,随着树脂添加量的不断增加,多糖保留率和脱蛋白率总体上呈现先上升后下降的趋势。当添加量为10 % 时,多糖保留率达到 78.35%,脱蛋白率达到 72.50%。当树脂添加量超过10%时,除了吸附杂质外,AB-8 型大孔树脂可能还会吸附多糖,从而导致多糖保留率降低。因此,树脂添加量选择5%、10%、 15%作为响应面试验的3个水平。
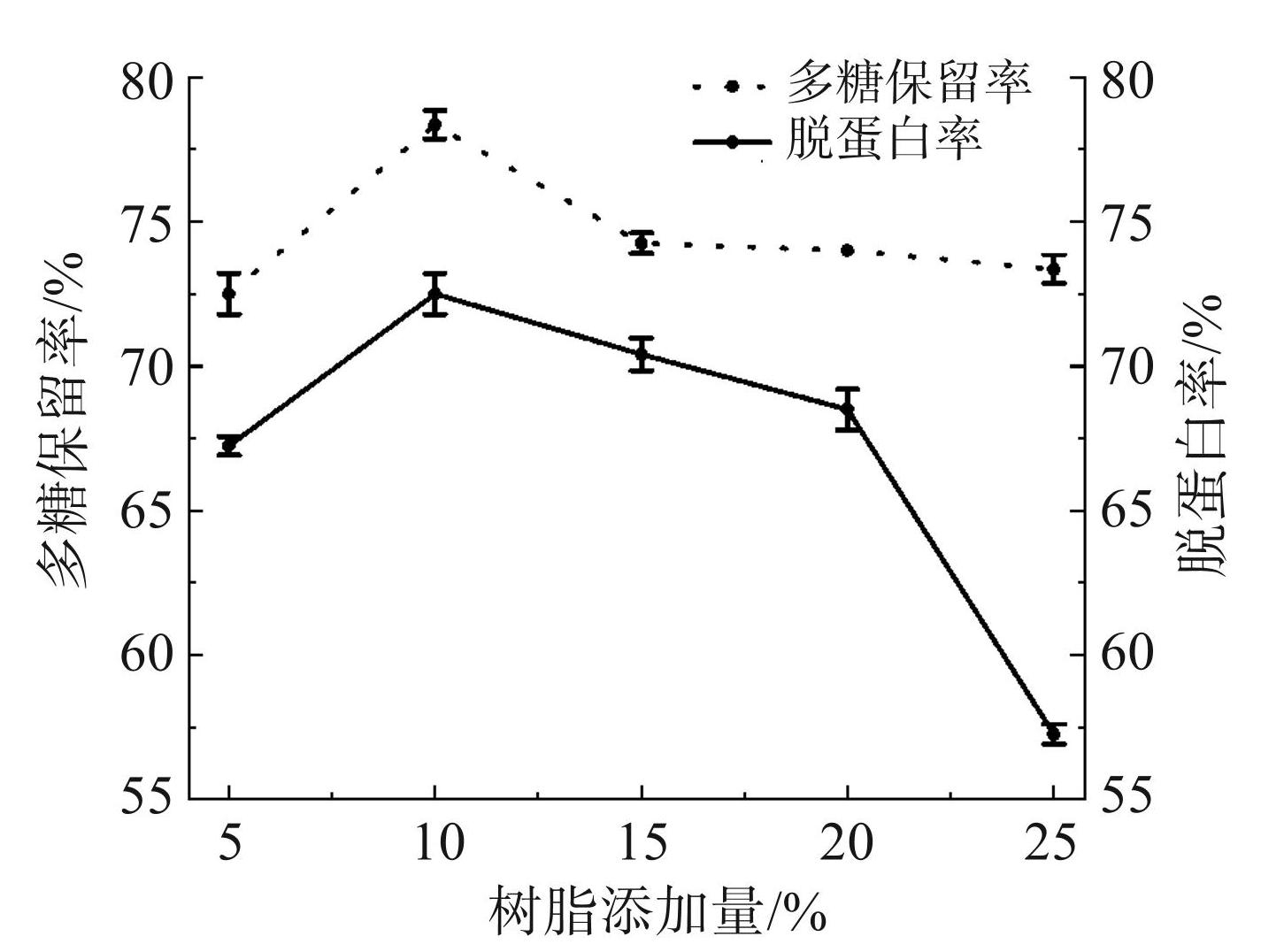
图1树脂添加量对多糖保留率和脱蛋白率的影响
2.2.2 pH对脱色效果的影响
由图2可知,随着脱色 pH 的增加,多糖保留率和脱蛋白率总体上也呈现先上升后下降的趋势。当 pH 为 7.0时,多糖保留率和脱蛋白率均达到最大值,分别为 80.65% 和 69.30%。而当 pH 小于或大于 7.0时,多糖保留率和脱蛋白率都呈现下降趋势。因此,脱色pH选择6.5、 7.0、7.5作为响应面试验的3个水平。
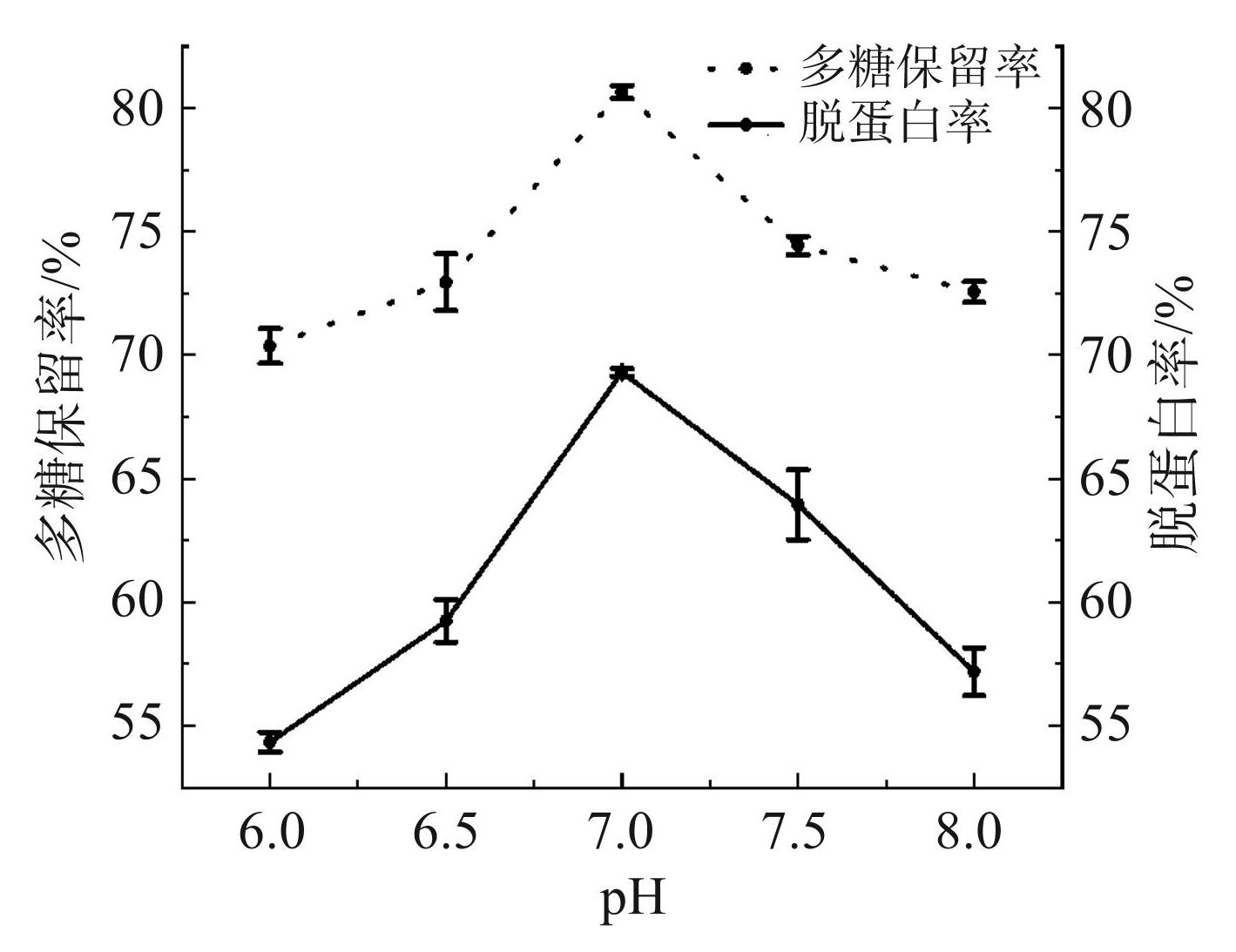
图2pH对多糖保留率和脱蛋白率的影响
2.2.3 脱色时间对脱色效果的影响
由图3可知,随着脱色时间的不断增加,多糖保留率和脱蛋白率呈现先上升后下降的趋势。当脱色时间为2.0 h时,多糖保留率达到76.50%,脱蛋白率达到69.20%。而当脱色时间超过2.0 h时,多糖保留率和脱蛋白率均开始下降。因此,脱色时间选择 1.5、2.0、2.5 h 作为响应面试验的3个水平。
2.2.4 脱色温度对脱色效果的影响
由图4可知,随着脱色温度的不断升高,多糖保留率和脱蛋白率总体上呈现先上升后下降的趋势。当温度为 30℃ 时,多糖保留率和脱蛋白率均达到最大值,分别为 85.40% 和 76.35%。而当脱色温度超过 30℃时,多糖保留率和脱蛋白率则开始下降。因此,脱色温度选择25、30、35℃作为响应面试验的3个水平。
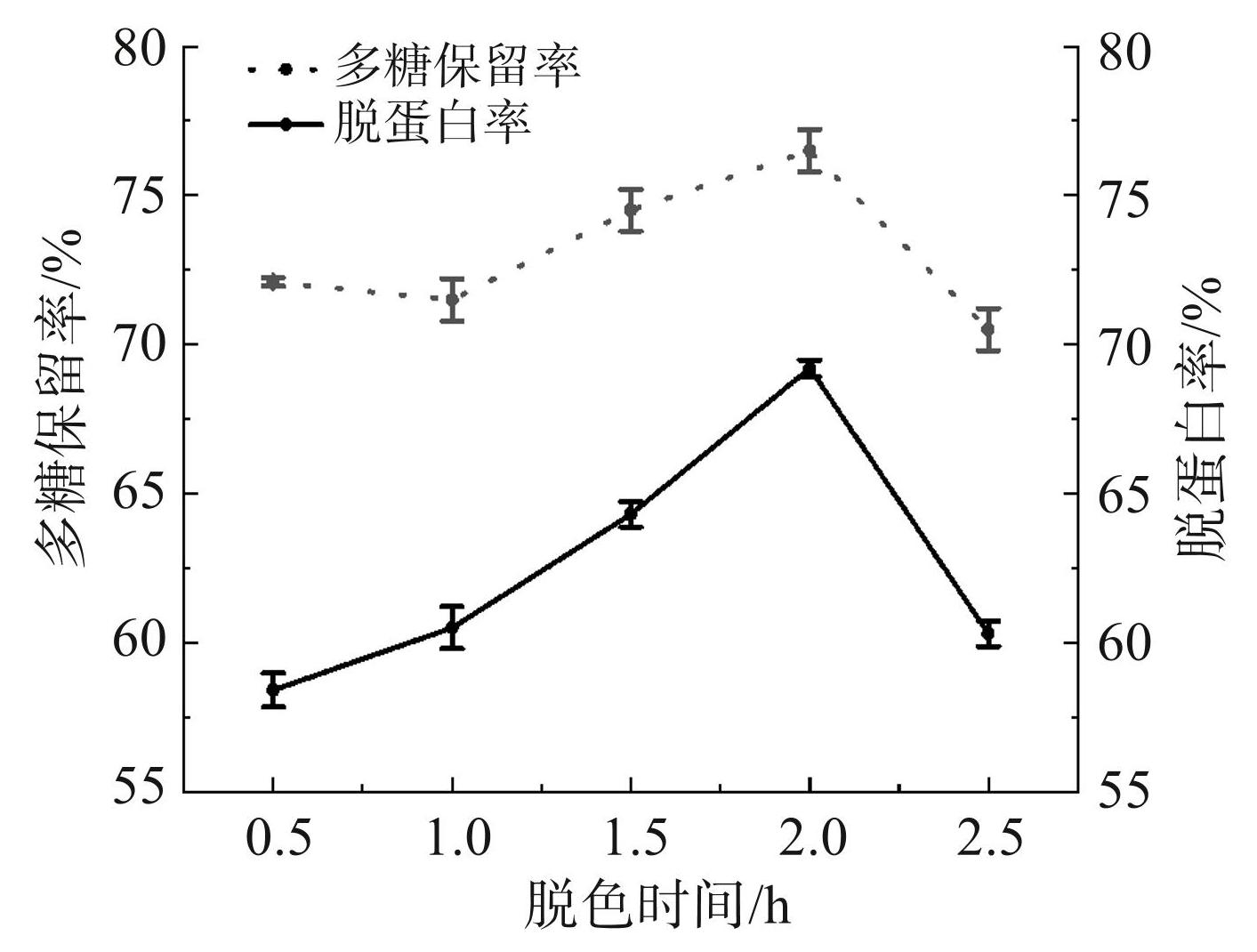
图3脱色时间对多糖保留率和脱蛋白率的影响
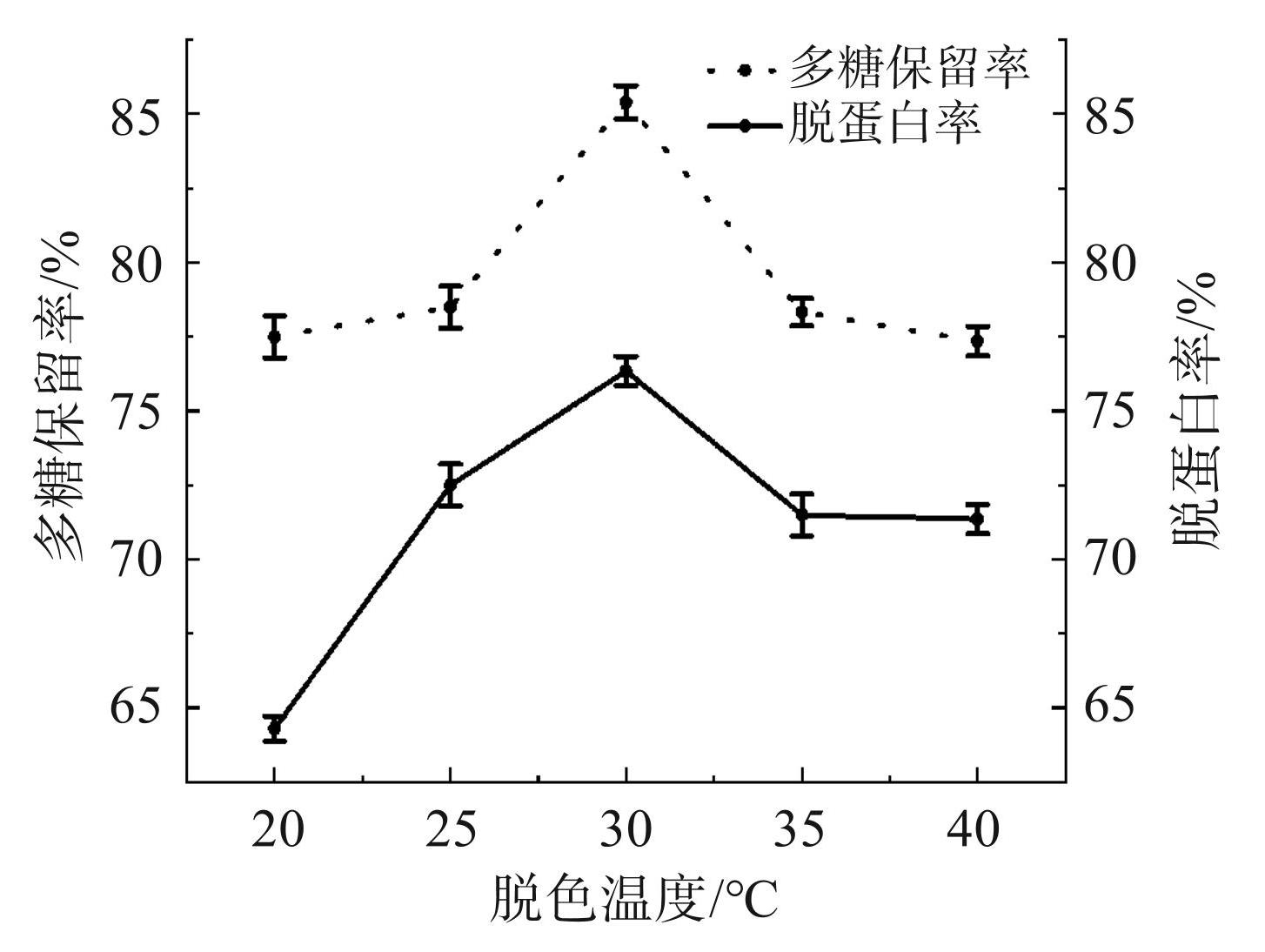
图4脱色温度对多糖保留率和脱蛋白率的影响
2.3 响应面试验结果分析
2.3.1 响应面试验设计及结果
在单因素试验基础上,以树脂添加量(A)、脱色 pH(B)、脱色时间 (C)、脱色温度(D)为考察因素,以多糖保留率(Y1) 和脱蛋白率(Y2)为考察指标,进行4因素3水平的响应面分析,对羊栖菜多糖的脱色工艺进行优化,以确定羊栖菜多糖的最佳脱色工艺条件。利用 Design Expert 13.0.1 软件对表3中的数据进行多元回归拟合分析,得多糖保留率的二次回归模型方程:Y1= 72.48-0.22A-0.65B-1.63C+0.25D +0.02AB-0.15AC-0.75AD-0.25BC-0.17BD-0.48CD-1.75A2-0.11 B2 + 0.79C2-2.37D2;脱蛋白率的二次回归模型方程为 Y2 = 67.44-0.17A-0.71B-1.67C+0.22D-0.33AB-0.50AC-0.7825AD-0.65BC-0.20BD-0.14CD-1.57 A2-0.15B2 +0.92C2-2.21D2。
2.3.2 回归模型的显著性检验及方差分析
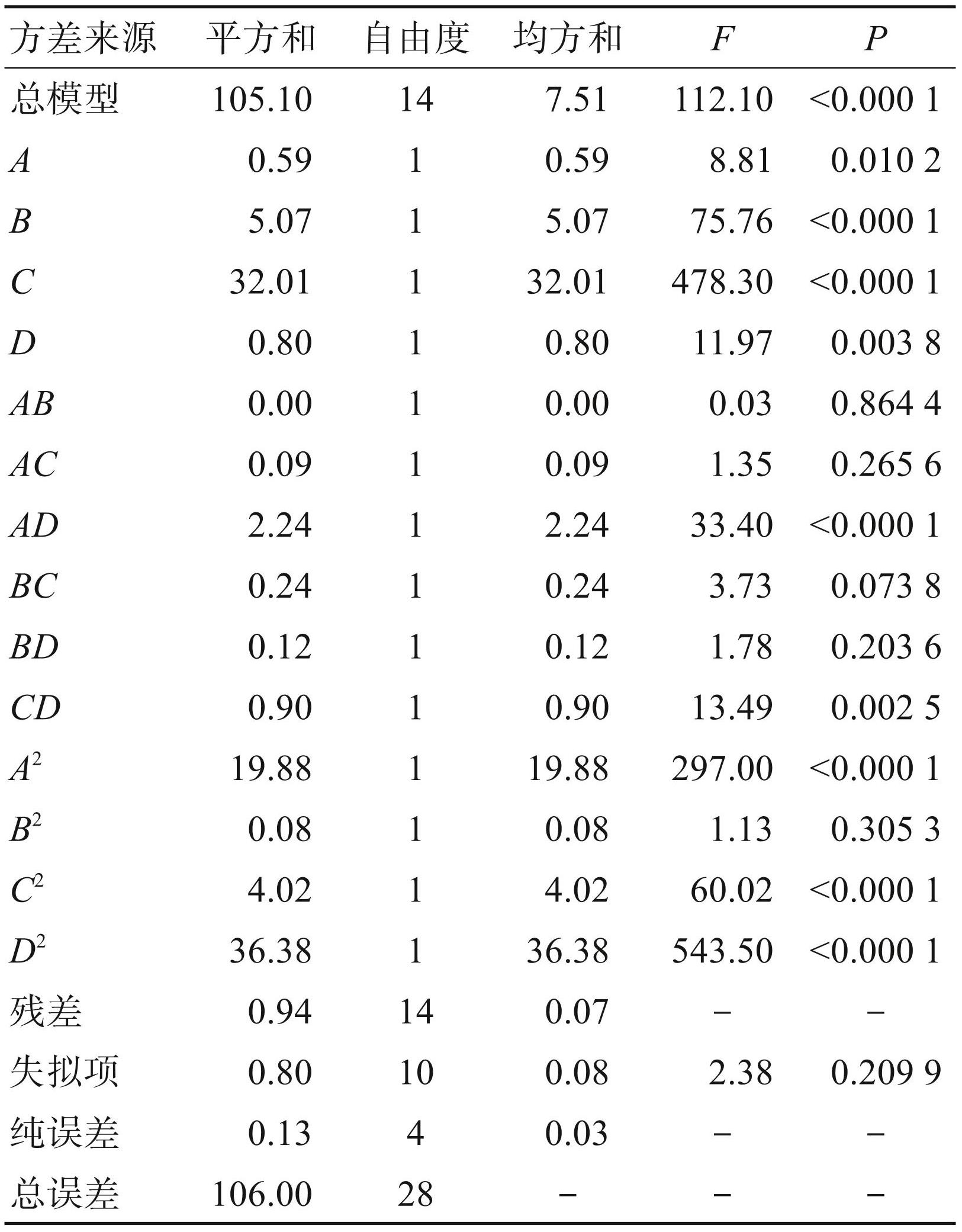
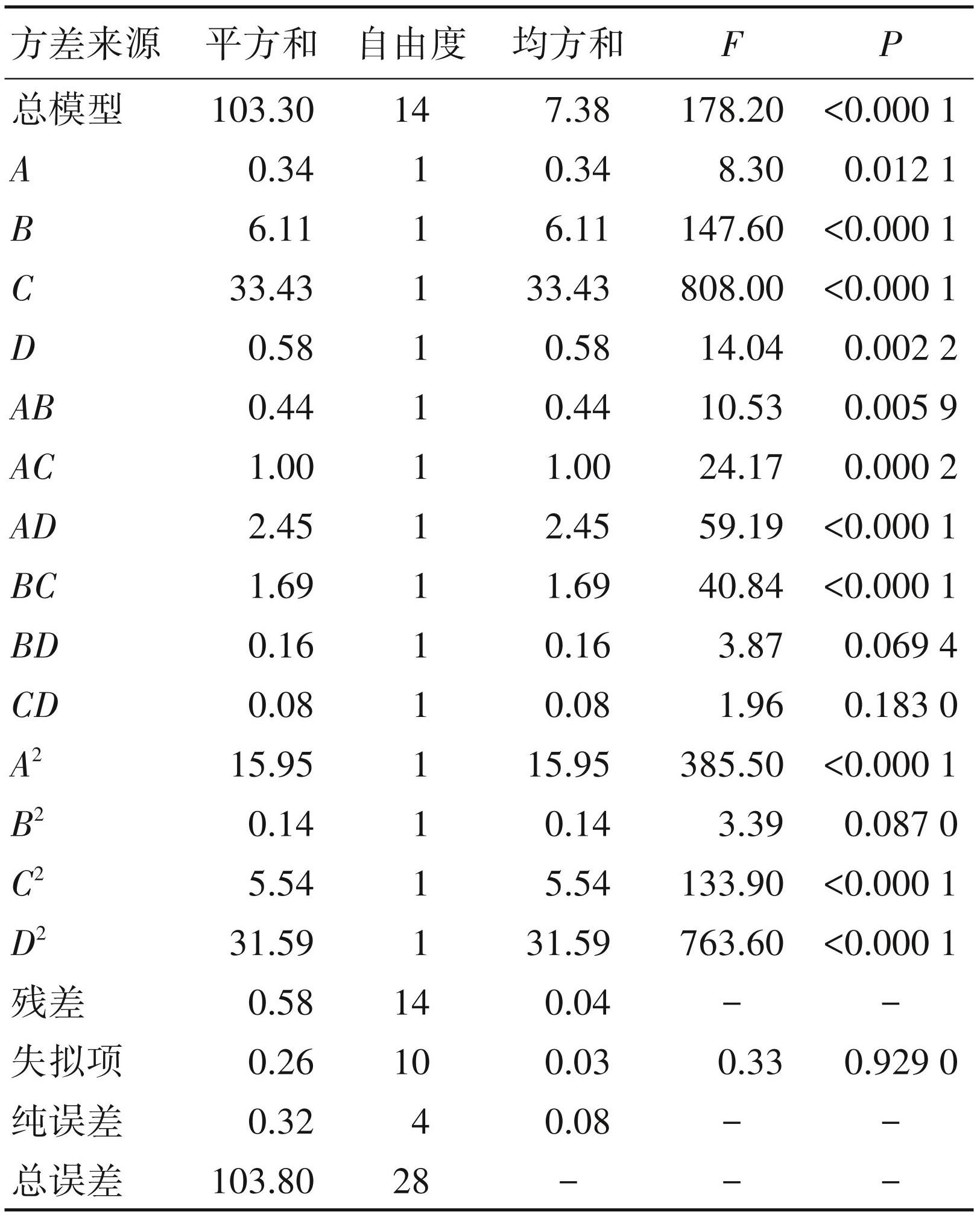
利用 Design Expert 13.0.1软件分别对多糖保留率和脱蛋白率的回归模型及各参数进行了显著性检验及方差分析。由表4和表5可知,多糖保留率和脱蛋白率回归模型的P<0.01,由此认定两个回归模型具有极显著性。另外,多糖保留率和脱蛋白率回归模型的相关指数分别为 R2 = 0.991 2 和 R2 = 0.994 4,且校正决定系数分别为R2 Adj= 0.982 3和R2 Adj= 0.988 8,均接近于1,表明模型的拟合程度较好,能准确预测和分析 AB-8 型大孔树脂的脱色工艺结果。从表4可知,在以多糖保留率为响应值的回归模型中,一次项B、C和D,交互项AD和CD以及二次项A2、C2、D2 对多糖保留率的影响极显著(P<0.01),而一次项 A 对多糖保留率的影响达到显著水平(P<0.05)。由表4中 F 值的大小可知,试验中各因素对多糖保留率的影响依次为C>B>D >A,即脱色时间>脱色pH >脱色温度>树脂添加量。从表5可知,在以脱蛋白率为响应值的回归模型中,一次项B、C和D,交互项AB、AC、AD、BC以及二次项A2、C2、D2 对脱蛋白率的影响极显著(P<0.01),而一次项 A对脱蛋白率的影响达到显著水平(P<0.05)。由表5中F值的大小可知,试验中各因素对脱蛋白率的影响顺序为脱色时间(C)>脱色pH(B)>脱色温度(D)>树脂添加量(A)。
表3响应面试验设计及结果
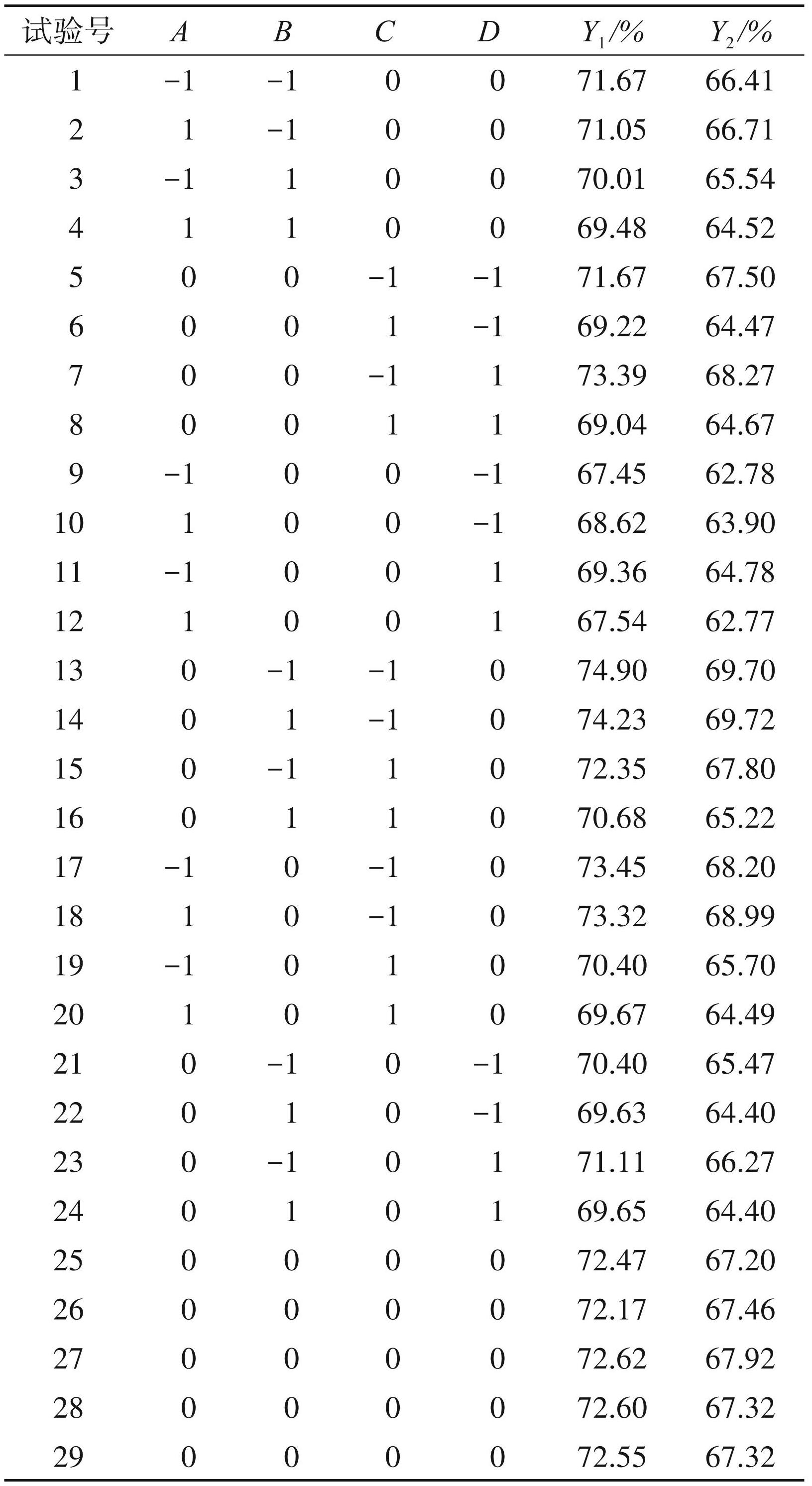
表4多糖保留率为响应值回归模型方差分析表
2.3.3 响应面图各因素交互作用分析
由图5可知,树脂添加量(A)与脱色温度(D)、脱色时间(C)与脱色温度(D)的响应面曲面的弯曲程度较大,且其等高线图为椭圆形,说明这两种交互作用对多糖保留率的影响达到极显著水平。由图6可知,树脂添加量 (A)与脱色pH(B)、树脂添加量(A)与脱色时间(C)、树脂添加量(A)与脱色温度(D)、脱色pH(B)与脱色时间(C)的响应面曲面的弯曲程度较大,且它们的等高线图均呈椭圆形,说明这些因素的交互作用对脱蛋白率的影响显著,与表5的方差分析结果一致。
2.4 工艺验证试验
经响应面试验优化后可得 AB-8型大孔树脂对羊栖菜多糖的最佳脱色工艺条件:树脂添加量为 10.25%,脱色 pH 为 7.31,脱色时间为 1.67 h,脱色温度为 30.52℃。在此条件下,预测的多糖保留率为 70.65%,脱蛋白率为 68.40%。考虑到实际可行性,调整树脂添加量为 10%,脱色 pH 为 7,脱色时间为 2 h,脱色温度为30℃。在此条件下重复3次平行试验验证,得到平均多糖保留率为 72.60%,与预测值的相对误差为2.76%;平均脱蛋白率为69.27%,与预测值的相对误差为1.27%。
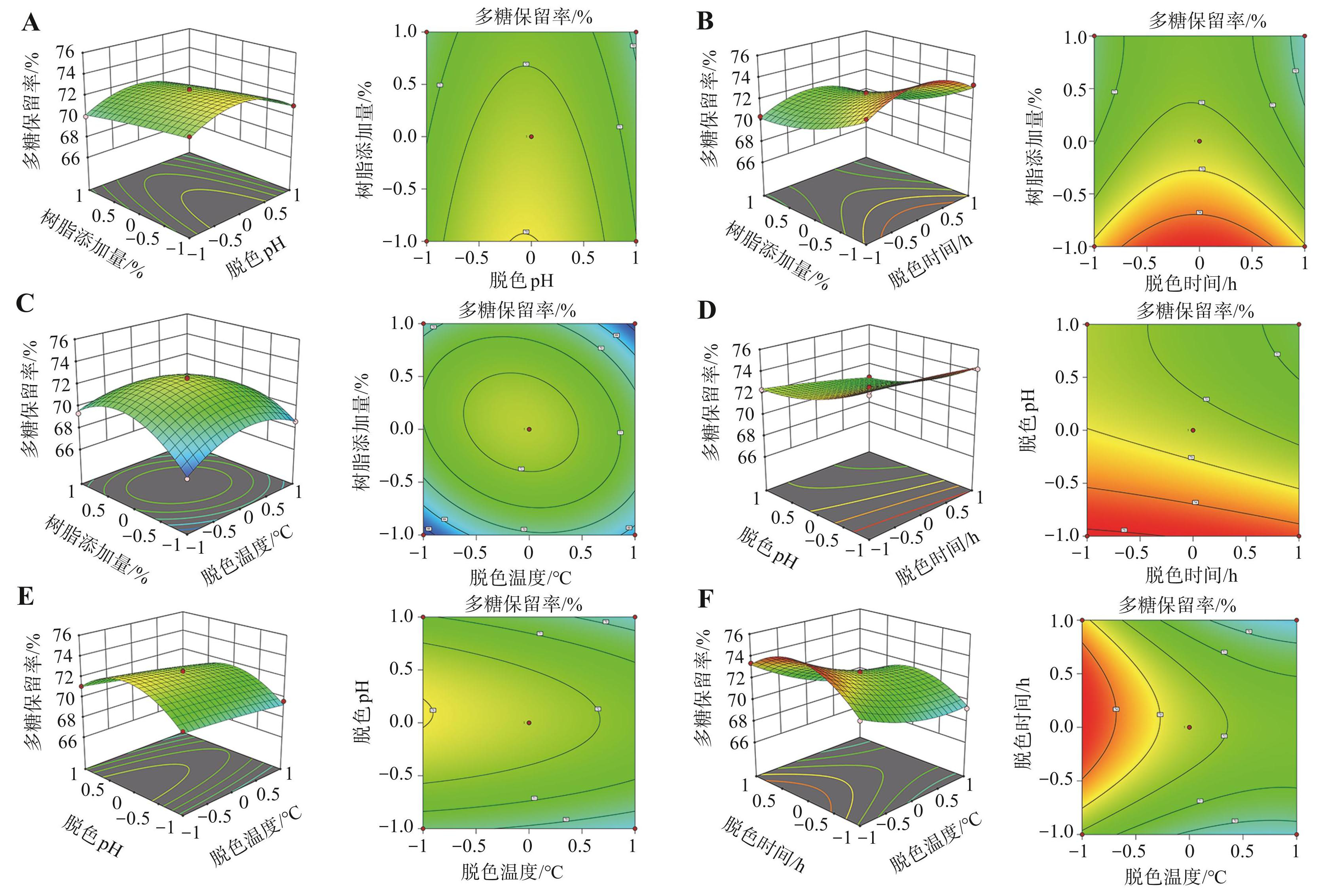
图5不同因素相互作用对多糖保留率影响的响应面和等高线图
A.树脂添加量和脱色pH对多糖保留率的影响;B.树脂添加量和脱色时间对多糖保留率的影响;C.树脂添加量和脱色温度对多糖保留率的影响;D.脱色pH和脱色时间对多糖保留率的影响;E.脱色pH和脱色温度对多糖保留率的影响;F.脱色时间和脱色温度对多糖保留率的影响。
表5脱蛋白率为响应值回归模型方差分析表
2.5 抗氧化活性测定
如图7所示,脱色前后的羊栖菜多糖和阳性对照药抗坏血酸对DPPH自由基和羟基自由基均具有较好的清除效果。当质量浓度为5.0 g/L时,脱色前的羊栖菜多糖对DPPH自由基和羟基自由基的清除率分别达到 69.85% 和 74.72%,而脱色后的羊栖菜多糖对DPPH自由基和羟基自由基的清除率分别达到 71.32% 和 78.95%,但均明显低于阳性对照药抗坏血酸的清除率(99.56%和99.41%)。另外,当质量浓度范围为1.0~5.0 g/L时,脱色前后的羊栖菜多糖对DPPH自由基和羟基自由基的清除能力均弱于阳性对照药抗坏血酸(P <0.01或0.05)。

图6不同因素相互作用对脱蛋白率影响的响应面和等高线图
A.树脂添加量和脱色pH对脱蛋白率的影响;B.树脂添加量和脱色时间对脱蛋白率的影响;C.树脂添加量和脱色温度对脱蛋白率的影响;D.脱色pH和脱色时间对脱蛋白率的影响;E.脱色pH和脱色温度对脱蛋白率的影响;F.脱色时间和脱色温度对脱蛋白率的影响。
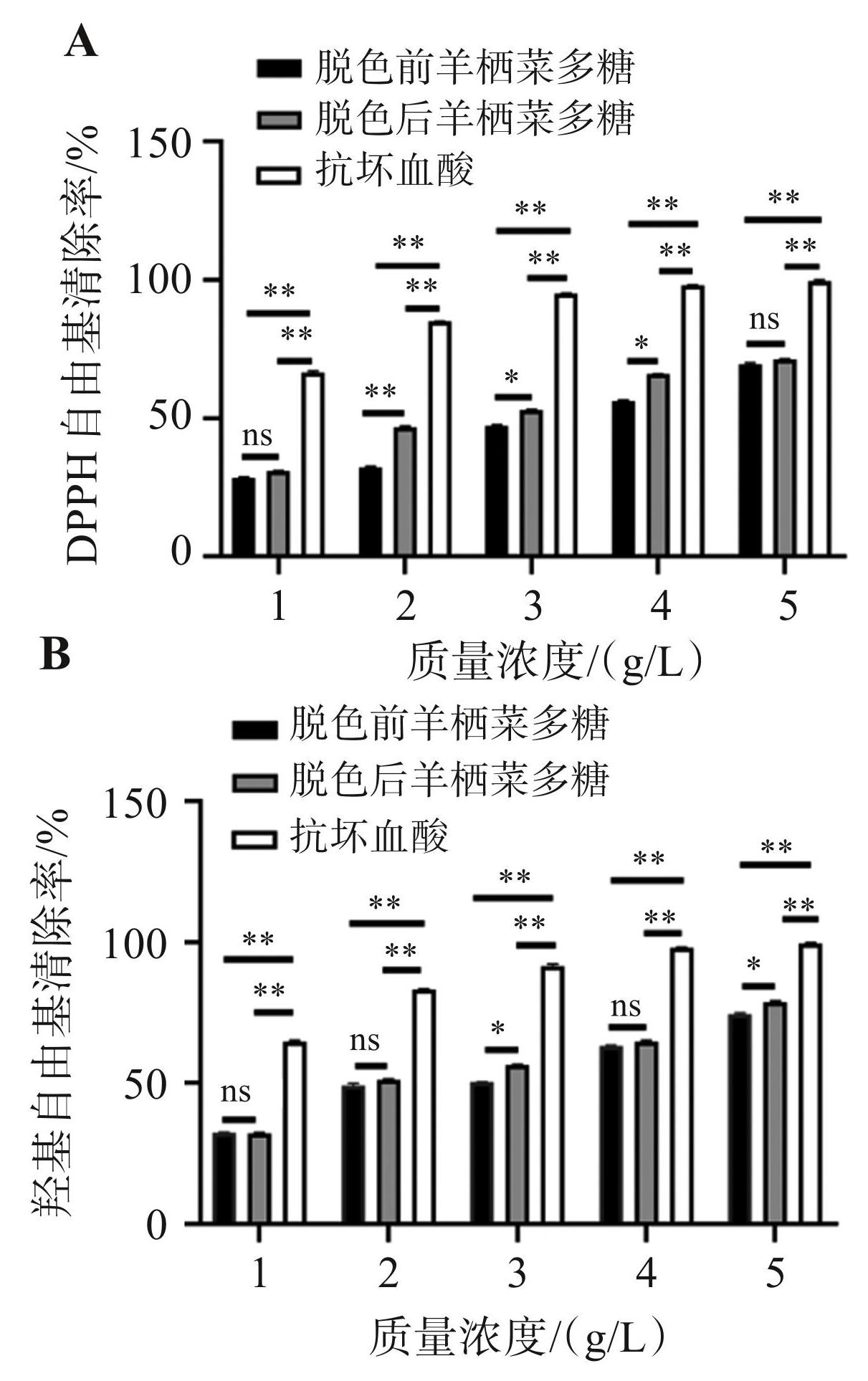
图7羊栖菜多糖对DPPH自由基(A)和羟基自由基(B)的清除能力
* P<0.05,**P<0.01,nsP>0.05。
2.6 红外光谱分析
脱色前后的羊栖菜多糖的红外光谱如图8所示。脱色前后的羊栖菜多糖的主要特征峰的波数没有发生明显的变化,表明羊栖菜多糖经 AB-8 型大孔树脂脱色后未发生多糖分子的降解。脱色前后的羊栖菜多糖的红外光谱中均存在 3 268 cm−1 处的吸收峰是-OH 伸缩振动产生的;1 634 cm−1 处的吸收峰是 C O 伸缩振动产生的;1 282 cm−1 和 1 090 cm−1 处的吸收峰是 C-O-C和 C-O-H伸缩振动产生的;874 cm−1 和 534 cm−1 处有吡喃糖环或呋喃糖环的伸缩振动峰。
O 伸缩振动产生的;1 282 cm−1 和 1 090 cm−1 处的吸收峰是 C-O-C和 C-O-H伸缩振动产生的;874 cm−1 和 534 cm−1 处有吡喃糖环或呋喃糖环的伸缩振动峰。
 O 伸缩振动产生的;1 282 cm−1 和 1 090 cm−1 处的吸收峰是 C-O-C和 C-O-H伸缩振动产生的;874 cm−1 和 534 cm−1 处有吡喃糖环或呋喃糖环的伸缩振动峰。
O 伸缩振动产生的;1 282 cm−1 和 1 090 cm−1 处的吸收峰是 C-O-C和 C-O-H伸缩振动产生的;874 cm−1 和 534 cm−1 处有吡喃糖环或呋喃糖环的伸缩振动峰。
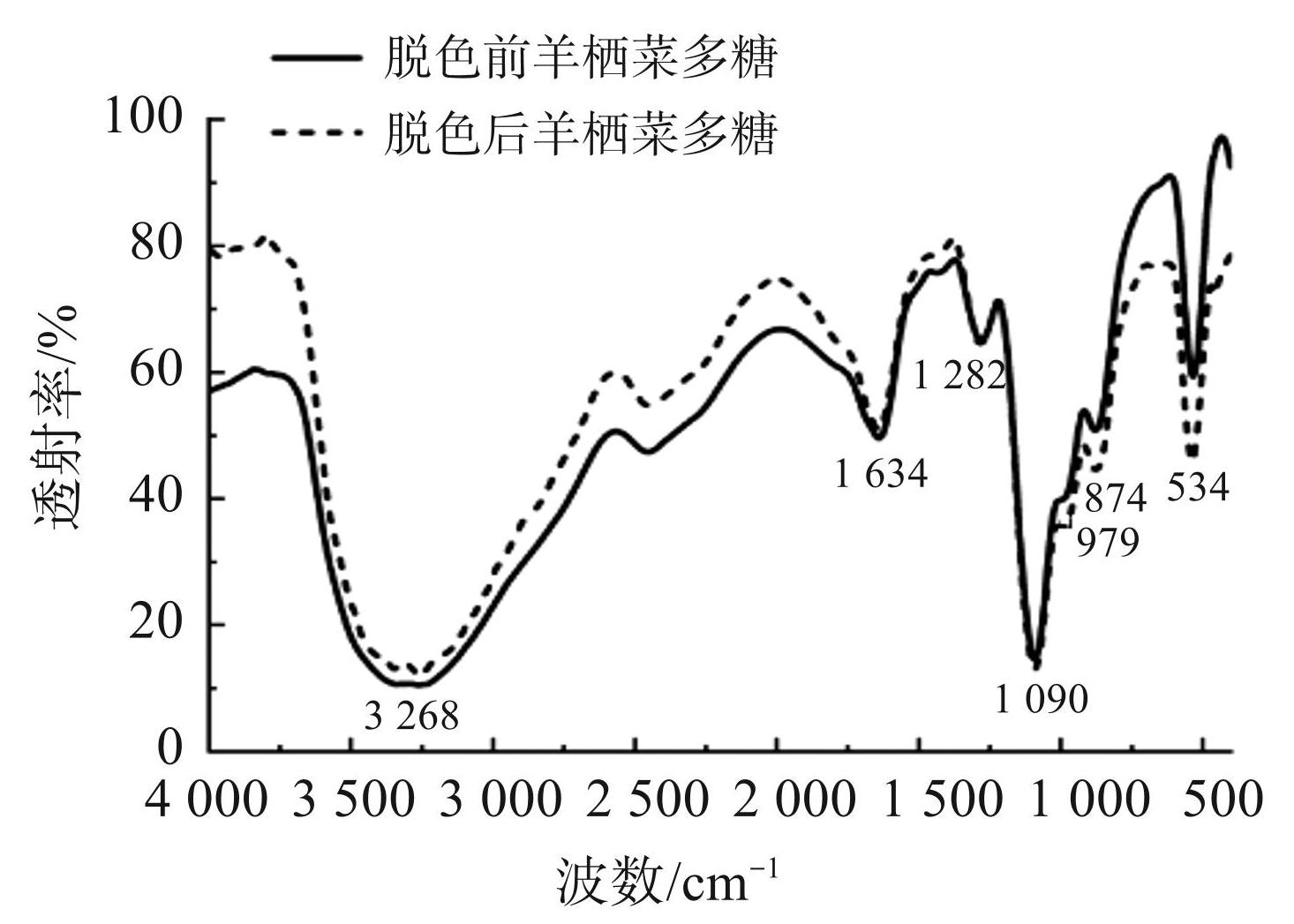
图8脱色前后的羊栖菜多糖的红外光谱对比图
2.7 细胞毒性实验
CCK-8 细胞毒性实验结果如图9所示,当给药 48 h 后,与 0 g/L 相比,脱色前后的羊栖菜多糖在 1.0~5.0 g/L 时(脱色前 4.0 g/L 除外)对 C3H10 细胞具有明显的促增殖作用(P <0.01或0.05),均不会产生细胞毒性。
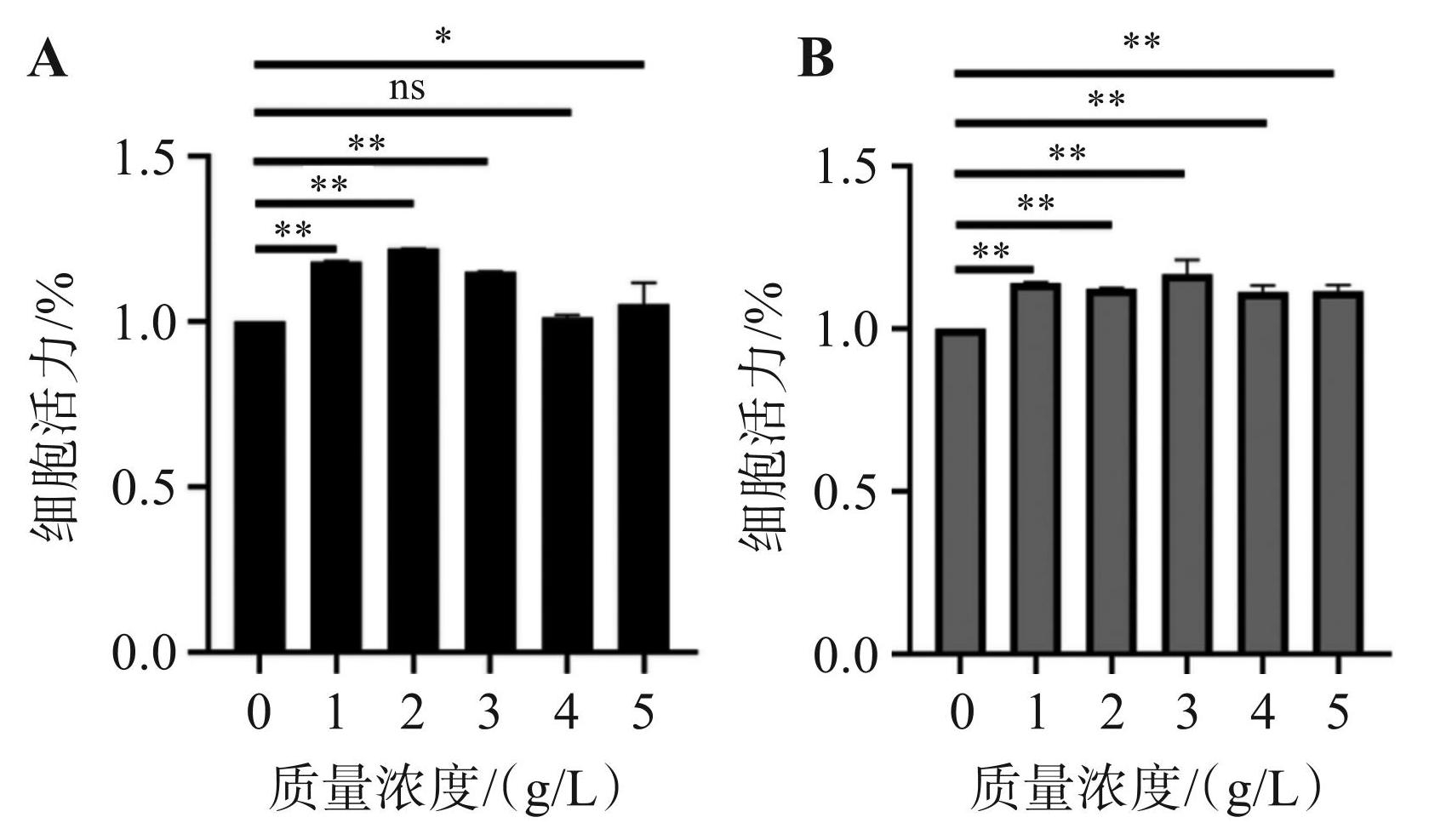
图9脱色前(A)和脱色后(B)羊栖菜多糖的细胞活力检测图
* P<0.05,**P<0.01,nsP>0.05。
3 讨论
随着我国对海洋资源开发的日益重视,海洋活性物质尤其是海洋多糖的开发与利用成为了研究的热点。大孔吸附树脂具有吸附快、吸附容量大、洗脱率高、树脂再生简便和抗污染能力强等优点,可通过物理作用选择性地吸附多糖提取过程中混有的蛋白质、水溶性色素等杂质,因此被越来越多地应用于海藻多糖的脱色[20]。AB-8 是弱极性大孔吸附树脂,它比非极性大孔吸附树脂 D101 表现出更高的多糖保留率,这可能是因为在脱色过程中多糖溶液中的色素和蛋白质等杂质更易受到 AB-8的强偶极离子力的作用而被吸附,导致 AB-8 对多糖的吸附较少。然而,目前对于羊栖菜多糖的脱色工艺研究却鲜有报道。2000 年,周峙苗等[11] 研究发现,利用过氧化氢 7%、乙醇 25%、乙酸酐 10% 和醋酸1%可对羊栖菜精粉进行脱腥、脱色处理,但目前尚未见利用大孔树脂来对羊栖菜多糖进行脱色处理的文献报道。因此,本研究以马尾藻科褐藻羊栖菜为研究对象,以多糖保留率和脱蛋白率为考察指标,采用水提醇沉法提取其多糖类成分,并比较了活性炭、过氧化氢、D101型大孔树脂和AB-8型大孔树脂4种脱色方法对羊栖菜多糖的脱色效果。本研究结果发现,与另外 3 种脱色方法相比,利用 AB-8 型大孔树脂对羊栖菜多糖进行脱色,其多糖保留率和脱蛋白率相对较高。因此,后续实验进行了AB-8 型大孔树脂脱色法的工艺优化。本研究首先考察了树脂用量、脱色温度、脱色时间和脱色pH 对羊栖菜多糖脱色效果的影响,并且通过响应面试验优化了 AB-8 型大孔树脂的脱色工艺,得到最佳脱色工艺条件:树脂添加量为 10%,脱色 pH为 7,脱色时间为 2 h,脱色温度为 30℃。在最佳脱色工艺条件下,进行3次重复实验,得到多糖保留率为72.60%,脱蛋白率为 69.27%。另外,本研究还通过测定 DPPH自由基和羟基自由基的清除率评价了脱色前后的羊栖菜多糖的体外抗氧化活性。在羊栖菜多糖对 DPPH 自由基清除能力的测定中,当质量浓度为 5.0 g/L 时,脱色前后的羊栖菜多糖对 DPPH 自由基的清除率达到最大,分别为 69.85% 和 71.32%,但均明显低于阳性对照药抗坏血酸的清除率 (99.34%)。而在羊栖菜多糖对羟基自由基清除能力的测定中,当质量浓度为 5.0 g/L 时,脱色后的羊栖菜多糖对羟基自由基的清除率达到78.95%,而脱色前的羊栖菜多糖对羟基自由基的清除率为 74.72%。因此,在一定质量浓度范围内,随着羊栖菜多糖质量浓度的增大,其对 DPPH 和羟基自由基的清除能力也逐渐增强,且呈现出明显的质量浓度依赖效应。在脱色前后的羊栖菜多糖体外抗氧化活性对比中,当质量浓度为 2.0~4.0 g/L 时,脱色后的羊栖菜多糖对DPPH自由基的清除能力稍强于脱色前的(P<0.01或0.05);而当质量浓度为3.0 g/L和 5.0 g/L时,脱色后的羊栖菜多糖对羟基自由基的清除能力也稍强于脱色前的(P<0.05)。上述试验结果表明,AB-8型大孔树脂在纯化羊栖菜多糖的过程中提升了羊栖菜多糖对DPPH自由基和羟基自由基的清除作用。而刘洪超等[12-13] 研究也发现,羊栖菜多糖具有良好的清除DPPH自由基和羟基自由基的作用,与本研究结果一致。
综上,本研究通过比较 4 种脱色方法对羊栖菜多糖的脱色效果,得出 AB-8 型大孔树脂脱色法为羊栖菜多糖的最佳脱色方法。随后,本研究采用单因素试验和响应面试验优化了 AB-8型大孔树脂的脱色工艺,并进一步明确了羊栖菜多糖的体外抗氧化活性,为羊栖菜多糖作为一种天然抗氧化剂在食品、医药和化妆品等领域中的开发与利用提供了理论基础和科学依据。













