摘要
过敏性疾病的发病率逐年增高,不仅会使患者的生活质量下降,也给国家带来了巨大的社会和经济压力。药物作为主要的致敏物质来源之一,是引起致死性超敏反应的重要原因。药物超敏反应(DHRs)的正确诊断对患者和医疗保健都是非常重要的,决定能否维持原有一线治疗方案不变。现有DHRs的诊断主要基于详细的临床病史,并且结合体内试验和(或)体外实验的结果进行综合判断。然而,现有DHRs的诊断存在程序复杂、耗时,需要训练有素的人员,缺乏标准化药物、标准化体内试验和体外实验的操作流程等诸多限制,这都阻碍了DHRs的确切诊断。该文概述了目前临床上可获得的DHRs诊断方法以及它们存在的局限,并就现有问题指出后续的研究方向。
Abstract
The incidence of allergic diseases is increasing year by year, which not only results in a decrease in the quality of life for allergic patients but also causes enormous social and economic burdens on the country. Drugs, being one of the main sources of allergens, are an important cause of life-threatening hypersensitivity reactions. Correct diagnosis of drug hypersensitivity reactions (DHRs) is crucial for both allergic patients and healthcare providers, as it determines whether to maintain the existing first-line treatment. The current diagnosis for DHRs relies on the detailed clinical history, combined with the results of in vivo and/or in vitro tests. However, the currently available diagnositic methods for DHRs have many limitations, such as complex and time-consuming procedures, the need for well-trained professionals, a lack of standardized drugs, and standardized operating procedures for in vivo and in vitro tests, all of which hinder the accurate diagnosis of DHRs. The review will provide an overview of the currently available diagnostic methods for DHRs in clinical practice and their existing problems, subsequently point out future research directions based on these issues.
Keywords
药物超敏反应(DHRs)是机体暴露于治疗剂量药物时引起的一种不良反应[1],近几十年内其发病率不断增加[2]。药物作为主要的致敏物质之一,是引发致死性超敏反应的重要原因[3]。目前 DHRs 诊断是基于临床病史,体内试验和(或)体外实验的结果综合判断,其正确诊断可为患者临床用药提供安全保障,降低患者临床用药风险。然而,目前DHRs 的诊断存在程序复杂、耗时,缺乏训练有素的人员、标准化的药物及操作流程等[4],这都阻碍了DHRs的确切诊断。本文将概述目前DHRs诊断现有的方法以及局限,并就现有局限概述解决措施以及指出后续的发展方向。
1 DHRs的分类
DHRs按照发生机制可分为免疫学和非免疫学介导。免疫学引起的 DHRs 根据 Gell 和 Coombs 可分为 4 大类:其中Ⅰ、Ⅱ和Ⅲ型 DHRs 是抗体介导的,Ⅳ型超敏反应是 T细胞介导的,DHRs主要以Ⅰ 和Ⅳ型最为常见[5-6]。非免疫学引起的超敏反应也称为非过敏性超敏反应,包括肥大细胞(mast cells, MCs)和(或)嗜碱性粒细胞的直接激活、药物特异质反应和细胞因子释放反应等[7-8],如目前被批准用于临床的阳离子药物(氟喹诺酮类抗菌药物、神经肌肉阻断药物、阿片类药物、抗抑郁药和放射性造影剂等)均能够通过非 IgE 依赖途径直接激活 MCs引起 DHRs[9]。此外,也可按照暴露于药物后 DHRs的发生时间可将其分为速发型超敏反应(I-DHRs)和迟发型药物超敏反应(NI-DHRs)。I-DHRs 通常是指暴露于药物后 1~6 h 内出现的不良反应,部分患者可立即发生,半小时内达高峰[5],主要包括 IgE 引起的Ⅰ型超敏反应以及非过敏性药物超敏反应[8]。 NI-DHRs则为暴露于药物 6 h后到数天甚至数月发生的不良反应,主要通过抗体和(或)T 细胞介导[5,8]。然而,临床上因个体因素和药物代谢时间差异的存在,I-DHRs可以延迟发作而NI-DHRs也可能会提前发生[10]。
2 DHRs的诊断方法
DHRs 的诊断主要基于详细的临床病史,并且结合体内试验和(或)体外实验的结果进行综合判断。体内试验是指使患者再次暴露于潜在致敏药物中,观察患者出现的各种临床表现和局部反应的一种试验[11],主要包括皮肤试验(skin test,ST)和药物激发试验(drug provocation test,DPT)[7];体外实验包括对风险基因、体液(如血液、尿液等)中特异性生物标志物以及基于超敏反应效应细胞开展的功能学分析,如嗜碱性粒细胞激发实验(basophil activation test,BAT)、肥大细胞激发实验(mast cell activation test,MAT)以及淋巴细胞转化实验 (lymphocyte transformation test,LTT)等[12]。 DHRs 的诊断流程见图1。
2.1 临床病史
DHRs 的诊断首先基于详细的临床病史,包括反应发生时的临床表现、基础疾病和伴随因素,潜在致敏药物的特征(包括用药后反应的发生时间、停药后相关症状是否消失、该药物之前是否有类似的报道等)以及患者基本信息、既往药物过敏史和家族过敏史[11,13]。尽管基于临床病史判断存在局限,但其是后续检测方法选择的重要参考依据[4]。
DHRs 主要表现为皮肤症状,但也可累及其他器官或导致多系统损伤[11]。I-DHRs 临床表现包括轻微的皮肤潮红和瘙痒,进一步可表现为荨麻疹、血管性水肿、喉头水肿、支气管痉挛、哮喘等,甚至严重过敏反应以及过敏性休克(多器官累及)[8,11,14-15]。NI-DHRs也通常以皮肤症状为主(临床上以多形性红斑或皮疹常见),当伴随其他系统性损伤的病变(最常累及淋巴结、血液系统和肝脏引起贫血、中性粒细胞减少症、血小板减少症及肝炎等,可危及生命)时被称为药物介导的超敏反应综合征(DIHS)或药物介导的迟发性多器官超敏反应综合征[11]。目前DIHS尚无统一的诊断标准,《DIHS 诊治专家共识》(中国医师协会皮肤科医师分会变态反应性疾病专业委员会)(2018版)建议当出现以下临床表现或实验室指标异常时应考虑存在 DIHS 的可能:(1)迟发性皮疹:暴露于药物至皮疹出现时间间隔大于 3周;(2)淋巴结肿大:≥2个部位的淋巴结肿大;(3)发热:体温 >38℃;(4)内脏损害:丙氨酸氨基转移酶为正常值2倍以上、间质性肾炎、间质性肺炎或心肌炎;(5)血液学异常:白细胞升高或降低,嗜酸性粒细胞 ≥ 1.5 × 109 /L 或不典型淋巴细胞 >5%;(6)复发病程:尽管停用诱发药物并给予治疗,疾病仍出现病情复发或加重[16]。符合前5条即可确诊DIHS。
2.2 体内检测
2.2.1 ST
ST 是广泛用于明确是否发生 DHRs 的诊断方法,它能够用于评估药物之间可能存在的交叉反应或者作为寻找其他安全替代药物的有效手段[17]。ST 的应用局限主要为大多数药物缺乏确切的试验浓度[18],目前仅有几种青霉素类(阿莫西林、克拉维酸)等药物的商业化诊断产品在部分国家可获得[19]。目前ST的操作流程已经被标准化,主要用于 I-DHRs尤其是 β-内酰胺类抗菌药物引起的超敏反应的诊断[20],对于 NI-DHRs 的阳性率较低[21]。在开始 ST 前需要常规停用部分药物,包括 H1抗组胺药、H2 抗组胺药物、丙咪嗪/吩噻嗪以及糖皮质激素等[11,22]。
ST包括SPT、PT和IDT[17]。SPT适用于I-DHRs 的诊断[17]。SPT 阳性的判断标准为当试验实施 20 min后,潜在致敏药物引起的风团直径至少比阴性对照直径大 3 mm,并且周围伴有红斑;该试验通常以 10 g/L 的组胺作为阳性对照,生理盐水和(或) 稀释用的溶剂作为阴性对照[17]。SPT 的灵敏度较低,但是具有较好的特异性(98.8%)和阴性预测价值(85.7%)[23]。IDT能够用于I-DHRs和NI-DHRs的诊断,其对 β-内酰胺类抗菌药物、放射性造影剂、肝素、全身麻醉药和铂类化合物的灵敏度较高[17]。 IDT一般在前臂掌侧皮内注射约0.02~0.05 mL的药液,风团直径在注射后即刻以及注射 20 min 后测量,如果 20 min后测量的风团直径大于或等于注射后即刻测量直径 3 mm并且周围伴有红斑则可认为 IDT 阳性;对于 NI-DHRs 应延长时间进行结果判读[17]。PT可作为NI-DHRs诊断的有用工具[24],多用于非注射剂型药物或药物辅料引起的 NI-DHRs。 PT在评估急性全身性脓疱病(AGEP)和伴嗜酸性粒细胞增多和全身症状的药物皮疹(DRESS)方面具有良好的灵敏度以及耐受性,而在黄斑丘疹(MPE) 和中毒性表面坏死溶解症(TEN)中的灵敏度较低[17]。一项多中心临床研究表明 PT 是识别药物引起的严重皮肤不良反应(AGEP、DRESS、MPE 和 TEN等)有效且安全的方法[24-25]。目前为止,国外或国内ST尚缺乏统一的测试浓度标准,在临床实践中药物具体的使用浓度需要结合指南建议,患者的皮肤状态和药物种类等实际情况综合考虑并调整,避免高浓度的测试药物引起的皮肤刺激反应,以获得皮肤试验的最佳试验浓度[11]。常见药物 ST 的推荐使用浓度见表1。

图1DHRs的诊断流程
p-MAT:被动肥大细胞激发实验;ELISpot:酶联免疫斑点实验;SPT:皮肤点刺试验;PT:斑贴试验;IDT:皮内试验。
2.2.2 DPT
DPT是确定是否存在 DHRs以及寻找其他安全有效替代药物的金标准[26],其是一种以寻求阴性结果为目的的体内试验。DPT 可以选择口服、鼻腔、吸入或静脉注射等途径,最终取决于潜在致敏药物的给药途径[4]。DPT引发超敏性不良反应的风险通常会较局部的ST更高,有研究表明在基于DPT 判断接受抗肿瘤药物治疗的患者是否发生超敏反应时约有 30% 的受试者出现了严重的超敏反应[27],因此 DPT禁用于曾出现致死性超敏反应的患者,且仅在经评估后益处大于风险时才可以开展。 DPT 的结果判读取决于患者暴露于药物后的主观或客观症状,如果用药后出现明显的超敏反应症状,被视为阳性结果;如未出现任何不良反应则为阴性结果;如果患者用药后出现强烈主观症状但是不能被临床客观检测指标证实,或是服药后引起与超敏反应无关症状时,则视为结果无法判读[11]。然而,目前 DPT 尚无标准化的操作流程,在实际的临床实践中试验剂量、剂量递增间隔和给药天数以及阳性结果判定等方面存在差异[28]。因此,后续仍然需要进一步研究以标准化DPT操作流程[4]。
表1常见药物ST的推荐使用浓度
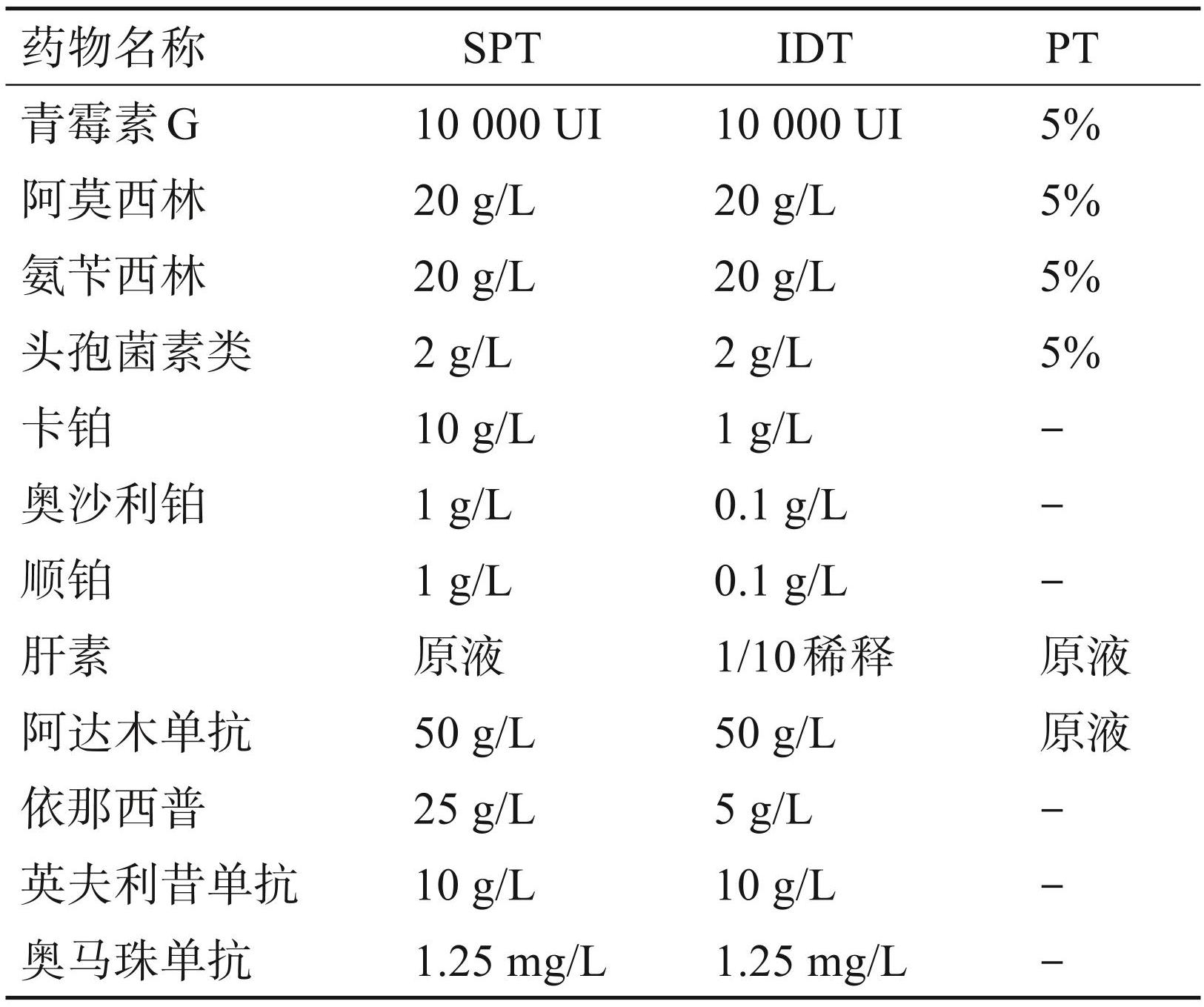
2.3 体外检测
体内试验判定DHRs是否发生存在评估过程复杂、耗时、成本昂贵以及存在引发致敏反应的风险等局限[12]。考虑到体内检测方法存在的局限性,体外实验可作为另一个重要选择和补充有助于促进对 DHRs 的诊断,且几乎不会对患者产生任何检测风险[11]。虽然有许多体外实验可以帮助识别和诊断潜在的DHRs,但只有少数体外实验在DHRs诊断上有足够的证据支持,仍需要进一步的研究提高它们的灵敏度和特异性[12,29]。体外实验通常是检测超敏反应急性期效应细胞表面激活标志物的表达,或检测它们释放的特异性炎症介质从而判断DHRs是否发生,此外部分体外实验有助于识别潜在的致敏药物[12]。然而,体外实验也存在一些局限:阴性结果无法排除DHRs的可能同时阳性结果虽然意味着患者对药物存在敏感性,但仍无法明确药物可以引起超敏反应[11]。此外,对于药物代谢产物而非药物本身引起的DHRs则无法通过体外实验进行检测[11]。
2.3.1 基因检测
人类白细胞抗原(HLA)已经被报道参与了 DHRs 的病理生理过程[30],具有某些 HLA 等位基因的患者在暴露于某些药物时严重皮肤不良反应的发生风险显著增加[31]。目前已发现某些特定的 HLA 等位基因的表达与 DHRs 存在高度遗传相关,如南亚人和欧洲人 HLA-B*15:02/HLA-B* 57:01 与卡马西平诱导的史蒂文斯-约翰逊综合征 (SJS)/TEN 有关[32],此外卡马西平引起的严重皮肤药物不良反应与 HLA-B*15:11、HLA-B*15:18、 HLA-A*31:01也有关[11];HLA-B*13:01与复方新诺明/氨苯砜诱导的严重超敏反应有关[33];HLA-B*57: 01与阿巴卡韦引起的超敏反应相关,可用于预测阿巴卡韦超敏反应,其检测灵敏度为 45.5%~80.0%,特异性为97.6%~99.0%[34-37];此外,HLA-II类等位基因与 I-DHRs 有关,包括 HLA-DRB5 和青霉素过敏有关;HLA-DRB1*10:01和 β-内酰胺类抗菌药物诱导的 I-DHRs 有关;此外,有研究指出 HLA-DRB* 12:01 可作为奥沙利铂超敏反应的遗传风险标志物[38]。这种带有特定的等位基因人群,暴露于某些药物后通常发生的 DHRs 类型为 T 细胞引起的 NIDHRs[11]。值得注意的是,HLA 等位基因筛查与种族相关,不同的 HLA等位基因发生的 DHRs临床表型会随着患者所属的种族的不同而不同[11]。
2.3.2 生物标志物检测
在超敏反应的急性期,通过检测血清、血浆、尿液或相关组织中总 IgE、特异性IgE(specific IgE,sIgE)、类胰蛋白酶、组胺及其代谢物等特异性标志物作为DHRs诊断的补充依据。
2.3.2.1 总 IgE/sIgE
相比较于 sIgE,总 IgE 水平不被认为是评估超敏反应的可靠标志物[22]。目前sIgE 的检测主要是基于免疫分析法,用药物载体偶联物功能化的固相检测血清中药物的 sIgE,主要的方法包括荧光免疫分析法(ImmunoCAP,Uppsala, Sweden),其中药物与聚L-赖氨酸共价结合;除了荧光免疫分析法还包括放射免疫分析或者酶联免疫分析,人血清白蛋白、氨基脂肪族间隔物和树状分子结构等也可被用作药物载体;纤维素、琼脂糖或二氧化硅颗粒等被用作固相[12]。基于 ImmunoCAP 的sIgE检测灵敏度通常比较低并与药物类型相关,但是特异性较高[12]。有研究指出基于免疫分析的 sIgE检测用于 β-内酰胺类抗菌药物过敏诊断时,灵敏度与过敏的严重程度、IgE浓度相关[39],特异性与 sIgE与总 IgE的比值相关[40-41]。ImmunoCAP目前仅适用于部分药物,如 β-内酰胺类抗菌药物(阳性率为 38%~85%)、神经肌肉阻断药(阳性率为 44%~92%)及生物制剂(阳性率为 26%~68%)[12,42]。 ImmunoCAP在检测生物类似物西妥昔单抗 sIgE 时的灵敏度为 68%~92%,特异性为 90%~92% [43]。 sIgE测定作为体内试验重要的补充,特别适用于既往发生过非常严重 DHRs 的患者,或存在 ST、DPT 禁忌的患者[42]。然而,sIgE 检测不能用于非 IgE 介导的DHRs的诊断,如绝大多数非甾体抗炎药、放射性造影剂等引起的DHRs[42]。
2.3.2.2 类胰蛋白酶
类胰蛋白酶为丝氨酸蛋白酶,是预存储于肥大细胞中的促炎介质之一,它的血清水平是诊断超敏最为常用的生物标志物之一[44]。目前,类胰蛋白酶的检测主要通过免疫测定法,但是目前缺乏成熟的检测体系,当其血清水平 >11.4 mg/L 时被认为存在超敏反应[12]。一项关于围手术期药物引起的严重超敏反应如过敏性休克的研究表明有 66.6% 的患者血清类胰蛋白酶水平 >13.5 mg/L[45],因此类胰蛋白酶水平能够较好地预测威胁生命的 DHRs[46]。在急性期测定类胰蛋白酶可用于明确肥大细胞反应,其灵敏度和特异性分别为 30.0%~94.1%、92.3%~94.4%[45,47]。由于类胰蛋白酶的半衰期为 90~120 min,应于症状出现后 30~120 min检测其水平,并与基础水平进行比较[48]。
2.3.2.3 组胺及其代谢物
组胺为嗜碱性粒细胞和肥大细胞颗粒中释放的主要过敏介质,也是速发型超敏反应中最丰富和最重要的炎症介质,其血浆水平的灵敏度为 61%~92%,特异性为 51%~91%[12]。鉴于血清中组胺的半衰期比较短仅有 20 min,因此可选择检测尿液中的组胺代谢产物 N-甲基组胺和 N-甲基咪唑乙酸,代谢物的半衰期可延长至24 h[46]。外周血清中组胺水平可通过放射免疫和酶联免疫吸附方法进行测定,其测定的灵敏度高于类胰蛋白酶[11]。
2.3.3 细胞分析
2.3.3.1 皮肤活检
皮肤活检是指使用组织学、免疫组化和(或)分子生物学方法来检测和定量累积在皮肤中的特异性细胞表面标记物和炎症介质[12]。皮肤活检操作简单,此外组织样本可以长时间储存并用于研究不同的细胞亚群和炎症介质[49]。然而,皮肤活检不能区分累及皮肤的DHRs和病毒感染引起的皮肤症状以及自身免疫性皮肤病,但是其能够区分正常皮肤以及严重的皮肤药物不良反应如 AGEP、MPE、DRESS和SJS/TEN等[12]。
2.3.3.2 细胞过敏原刺激实验
嗜碱性粒细胞、肥大细胞是 I-DHRs 的主要效应细胞,T 细胞作为 NIDHRs 的主要效应细胞,在致敏药物的刺激下它们能够被激活,细胞表面表达激活标志物并释放相关炎症介质引起超敏反应的发生,因此可通过检测在药物刺激下细胞表面特异性标志物表达以及炎症介质释放从而实现对DHRs的诊断。细胞过敏原刺激实验见图2。
2.3.3.2 .1 嗜碱性粒细胞
嗜碱性粒细胞作为速发型超敏反应的主要效应细胞之一,基于其开展的功能性分析实验即 BAT 可通过流式细胞术检测在药物刺激下嗜碱性粒细胞的活化标志物[50],该检测方法已被用于花粉、食物、毒素和药物等引起的超敏反应诊断。目前BAT尚未常规用于临床实践,但有研究表示其可以作为评估DHRs的辅助手段。BAT 通常适用于当常规的体内试验和体外实验分析结果不明确时或与临床病史不一致、或经评估使用上述检测方法存在潜在风险或没有可用的试剂时[50]。尽管BAT具有潜在的优势,但它仍然存在一些缺点阻碍了其广泛的应用,包括收集的全血样本尽量在 4 h内进行检测,不能实现对无反应患者的诊断以及 BAT很难被标准化[51]。
鉴于患者的全血样本收集比较困难以及临床检测时限等原因,来源于大鼠嗜碱性白血病(RBL) 细胞系的人源化或转染细胞系(RBL SX-38 和 RBL-48),该细胞系表达人 IgE高亲和力受体(FcεR Ⅰ)被应用于 IgE 介导的嗜碱性细胞激活以及后续脱颗粒的机制研究。然而,人源化细胞系的临床应用也存在诸多限制,包括在培养 2 周左右后它们的 IgE 结合能力下降[52];这些细胞系通常需要供体血清中高滴度的sIgE和高比例的IgE受体被占据才会达到令人满意的结果[53]。存在于患者血清中的人类异种反应性免疫球蛋白IgG会导致细胞死亡和高背景(脱颗粒高达 25%),通过稀释血清来降低背景可能导致嗜碱性粒细胞敏化欠佳,从而导致假阴性结果[54-55]。总之,基于人源化嗜碱性粒细胞系开展的 BAT仍有诸多局限,实现临床常规化检测仍有很长的路要走。
BAT 对青霉素类的灵敏度为 22.0%~55.0%,对克拉维酸的灵敏度为 52.7%,它们均具有良好的特异性为79%~96%[56];对神经肌肉阻断药的灵敏度为 64.0%~85.7%,特异性为 93.0%~100.0%[57],其中对罗库溴铵的灵敏度较高为 91.7%[58];对氟喹诺酮类抗菌药物的灵敏度为 36.0%~71.0%,特异性为90.0%[59]。BAT 被推荐用于 β-内酰胺类抗菌药物、神经肌肉阻断药引起的超敏反应诊断,可作为其他体外实验的补充。在一些可能发生危及生命的超敏反应或高风险患者中,BAT被推荐用于包括ST等体内试验之前用于筛选[12]。
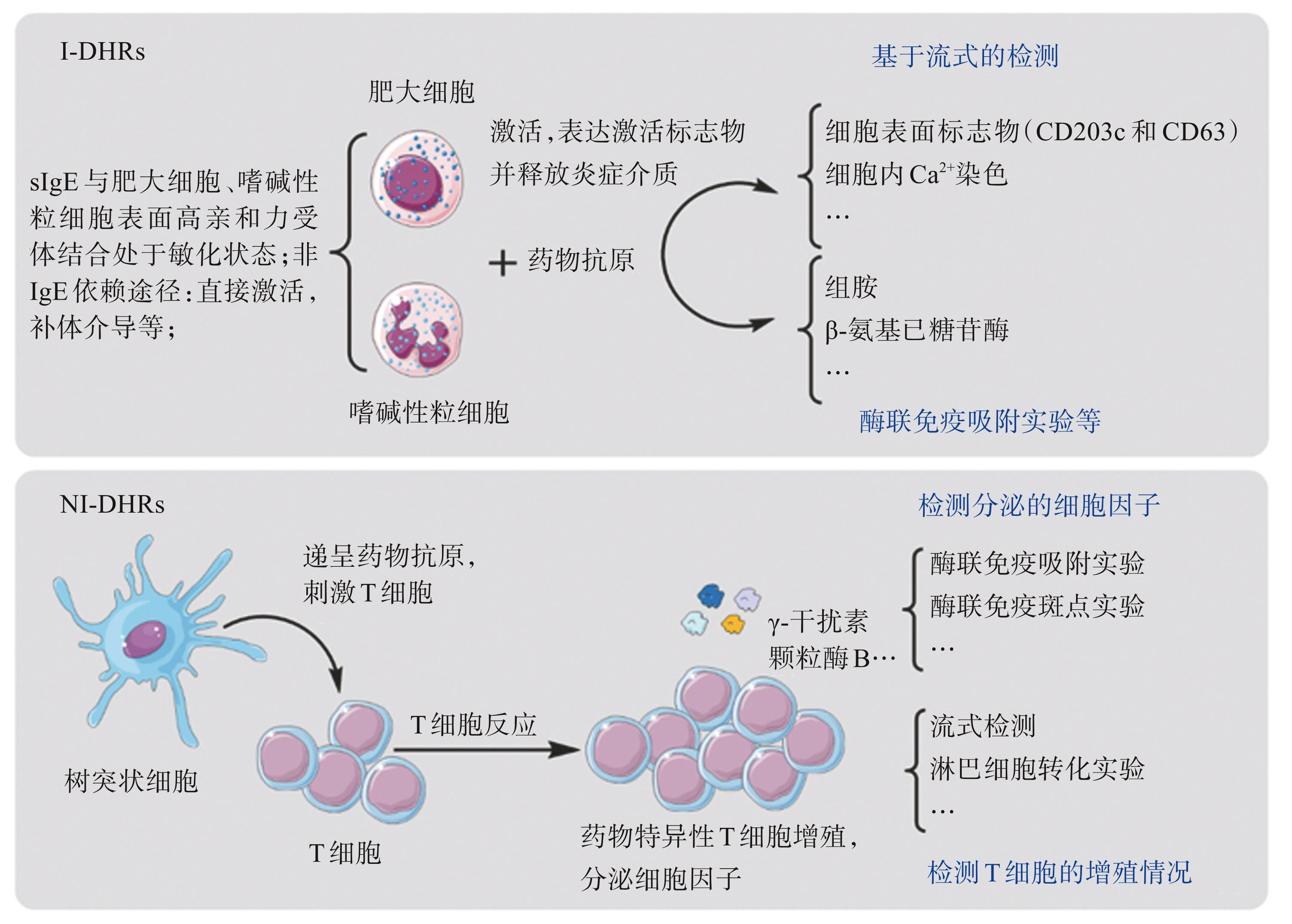
图2细胞过敏原刺激实验
2.3.3.2 .2 肥大细胞
组织聚集性MCs被认为是引起速发型超敏反应的另一主要效应细胞,由于组织聚集性的 MCs 相比于循环聚集性的嗜碱性粒细胞较难被获取,因此通常基于被动敏化的MCs开展功能性分析即 p-MAT[60]。p-MAT 主要依赖于定量检测在药物刺激下激发的 MCs 释放到上清液中的蛋白酶或炎症介质(如 β-氨基己糖苷酶、组胺等)[61]。目前人源化或人肥大细胞系较少,有研究指出 LAD2 细胞系可用于评估花生过敏和检测花生口服免疫治疗的效果,基于 LAD2细胞的 p-MAT在特异性方面与 BAT 相当为 98%,但诊断花生过敏的灵敏度较低为 73%[62]。来源于人诱导多能干细胞 (iPSCs)的人肥大细胞系iPSC-MCs也可用于p-MAT,但是该细胞系的寿命较短一般最多只能培养 8 个月,这也限制其在超敏反应诊断上的应用[63]。人原代 MCs 可以在细胞因子如干细胞因子、白介素 (interleukin,IL)-3和IL-6等存在下诱导来源于脐带血、骨髓、胎儿肝细胞或外周血单核细胞(CD34 + / CD113 +)分化成熟为 MCs而获得[64],但是上述样本较难获得。
被动敏化的人培养MCs能够被用于研究IgE依赖性的 MCs 激活,相关研究表明相比于 sIgE 检测、 SPT 和 BAT,p-MAT 在区分有或无临床反应性花生过敏患者方面的诊断准确性更好[61]。此外,该研究也表明p-MAT不仅能用于蛋白质过敏原如花粉、食物和毒素等引起的超敏反应的诊断,也可以用于 DHRs的诊断[61]。MCs表达 Mas相关 G 蛋白偶联受体,该受体在非免疫速发型超敏反应特别是非免疫 I-DHRs中具有重要的作用,可用于潜在致敏药物直接刺激 MCs 进行相关机制研究[65]。一项基于 p-MAT和BAT诊断罗库溴铵超敏反应的研究提示,在无法开展BAT 或在 ST、sIgE 检测结果不确定时,p-MAT 可以替代 BAT 诊断罗库溴铵引起的超敏反应[66]。p-MAT作为一种极富潜力的诊断方法,特别是在常规体内试验和体外实验不可用或检测结果不确定的情况下可作为额外选择和重要的补充,但是仍需要大量研究寻找稳定的人 MCs 系为后续标准化 p-MAT奠定基础。
2.3.3.2 .3 T细胞
LTT作为T细胞引起Ⅳ型超敏反应的体外诊断方法之一,该实验是基于药物特异性记忆 T 细胞的存在,在致敏药物的再次刺激下这些T 细胞能够增殖,通过检测特异性 T 细胞的增殖情况进而评估机体对药物的反应[67]。该试验通常是在临床症状消失后和类固醇激素治疗结束至少4周后进行[67]。 LTT 灵敏度和特异性不定,分别约为 27.0%~88.8% 和 63.0%~100.0%,它们主要取决于致敏药物的类别(通常在 β-内酰胺类抗菌药物、抗惊厥药物中较高)和临床症状[68-70],其在MPE、AGEP 和DRESS中的灵敏度较高,但在SJS/TEN中的灵敏度较低[11]。
ELISpot主要用于检测在致敏药物或其代谢物刺激下药物反应性T细胞释放相关细胞因子和细胞毒性标记物的含量[71]。药物反应性T细胞在反应数年后仍能够被检测,ELISpot 具有较高的灵敏度当每百万外周血单个核细胞中含有 100~256 个细胞因子和细胞毒性标记物的分泌细胞即能够被检测故其适用于高通量筛选[72]。基于 γ-干扰素的 ELISpot 被用于 β-内酰胺类抗菌药物引起的 NIDHRs诊断;基于颗粒酶B的ELISpot被推荐用于非速发型超敏反应的细胞毒性机制研究;为了提高检测的准确性,可以同时检测两种或两种以上的细胞因子[73-74]。
3 结语
实现DHRs的确切诊断有助于为患者临床用药提供安全保障,降低患者临床用药风险。尽管目前体内试验以及体外实验在DHRs诊断上发挥了重要的作用,但是尚存在诸多局限,如缺乏标准化药物、操作流程以及结果评价标准,可靠的诊断标志物以及高灵敏度、特异性诊断方法等,这均是将来需要重点研究的。此外,DHRs 的诊断需要结合临床病史、体内试验和(或)体外实验的结果进行综合判断,在具体病例中需要基于患者的具体情况综合考虑选择哪些检测方法,如何组合体内试验和(或)体外实验以及在 DHRs 急性期何时进行检测等,这些都将需要大规模临床试验进一步研究并明确。


