摘要
帕金森病(Parkinson’s disease,PD)是一种慢性神经退行性疾病,其特征包括运动和非运动症状,严重限制患者的日常活动。近年来的多项分子、生物学和遗传学研究表明,PD的易感基因在大脑以外的外周器官和组织均有表达,在骨细胞中也有表达。因此,这些研究合理地促使人们思考“帕金森病可能是一种全身性疾病”的观点。目前大量证据表明,帕金森病患者更容易发生骨质疏松和骨折,与年龄相匹配的对照组相比,帕金森病患者的骨折风险显著增加。该文阐述了帕金森病与骨骼系统相关性的研究进展,旨在为帕金森病患者骨骼健康的评估、管理、治疗和潜在研究方向提供参考。
Abstract
Parkinson’s disease (PD) is a chronic neurodegenerative disorder marked by both motor and non-motor symptoms, significantly impeding daily activities. Recent molecular, biological, and genetic investigations reveal the expression of PD susceptibility genes in peripheral organs and tissues, including bone cells, suggesting that PD may be classified as a systemic ailment. Evidence increasingly supports that individuals with PD are at heightened risk for osteoporosis and fractures, displaying a substantially greater incidence of fractures compared to age-matched controls. This article elaborates on the research progress of the correlation between Parkinson’s disease and the skeletal system, aiming to provide a reference for the assessment, management, treatment, and potential research directions of bone health in Parkinson’s disease patients.
帕金森病(Parkinson’s disease,PD)的发病率随着年龄增长而增加,患者通常在60岁后出现症状,但约有4%的患者在50岁前就开始出现症状,被称为早发性PD[1]。PD的主要运动特征包括静止性震颤、肌肉僵硬、运动缓慢(bradykinesia)和姿势不稳[2]。随着病情的进展,患者可能还会出现认知和情感障碍,如抑郁和痴呆[3]。在分子水平上,PD 的标志是多巴胺能神经元在中脑黑质部分的丧失,导致大脑中多巴胺水平下降,并且这种多巴胺神经元的丧失与 α-突触核蛋白(α-synuclein)中路易体的累积有关[4]。此外,线粒体功能障碍[5]、氧化应激[6]、神经炎症和程序性细胞死亡[7] 也在PD的发展过程中扮演重要角色。
随着人们开始关注 PD 患者的骨骼健康,有研究发现PD患者的骨密度(BMD)低于非帕金森病患者对照组[8-11],这不仅增加了跌倒的风险,也与PD患者骨折频率相关。骨质疏松症(Osteoporosis,OP) 是一种代谢性骨病,在中国50岁以上人群骨质疏松症的发生率为 19.2%,65 岁以上人群的发生率更是高达 32.0%[12]。从病理生理学的角度来看,OP的发病涉及多种因素,例如遗传、免疫、骨转换失衡、营养、内分泌因素如维生素 D 缺乏和雌激素减少等。 PD 患者骨质疏松症和骨折的发生率较高,提示 PD 可能直接或间接与骨骼系统有关。本文阐述了帕金森病与骨骼系统相关性的研究进展,从而为帕金森病患者骨骼系统健康的评估、管理、治疗和潜在研究方向提供参考。
1 帕金森病与骨代谢的关系
PD 是一种主要影响中老年人群的神经退行性疾病,在年龄增长和男性患者中的发病率和患病率较高[13],特征以运动症状为主。近年来对PD的研究越来越关注其非运动症状,尤其是与骨骼健康相关的症状。有研究发现,PD 与骨折的关系最密切,超过其他研究特征[14],且无论是否伴有骨质疏松症, PD发生骨折的风险都更高,特别是髋部骨折[15]。
需要注意的是,PD与骨健康问题之间的关系可能是双向的。一方面,PD可能通过上述机制直接或间接导致骨健康问题;另一方面,骨骼的健康状况也可能反过来影响 PD 患者的运动能力和生活质量。例如,PD患者广泛存在的运动功能障碍可能导致身体活动减少,是骨质流失和骨折风险增加的重要因素。通过综合评估PD患者的神经症状和骨骼健康,从而更全面地提高他们的生活质量和健康状况。
2 帕金森病与骨骼系统相关的病理生理机制
2.1 帕金森病与营养不良、骨健康的关系
PD 患者骨健康问题的机制可能涉及多个因素且较为复杂。首先,PD患者使用的某些药物可能影响钙吸收和骨重塑[16],从而对骨健康产生不利影响。同时,部分 PD患者还患有抑郁症,而与左旋多巴联合使用抗抑郁药物可能会增加髋骨或股骨骨折的风险[17]。此外,大量PD患者都会表现轻度至中度的营养消耗;营养消耗会导致维生素 D 和钙的缺乏,从而对骨健康产生不利影响。钙平衡失调在 PD的发展中起到重要作用[18],钙通道也被认为是PD神经保护治疗的潜在靶点[19]。PD 患者的维生素 D 缺乏发病率明显高于健康对照组,这提示帕金森病与维生素D缺乏之间存在特殊关联[20]。有研究发现,PD 男性患者比女性患者更容易发生骨质疏松症,可能归因于女性体内较高的维生素D和雌激素水平[21]。
营养不良同样也会导致血浆同型半胱氨酸水平升高,高同型半胱氨酸血症与骨折风险的增加之间存在着一种与骨密度无关的机制[22],还会抑制骨折的愈合,且与骨骼肌功能障碍、损伤以及血管完整性和功能下降密切相关[23]。因此,医务人员应对 PD患者的营养状况进行定期监测,确保通过膳食或补充剂摄入足够的维生素 D 和钙。性别和同型半胱氨酸水平等因素也应包含在评估范围内,以便更全面地了解PD患者的骨健康问题并进行干预。
2.2 帕金森病中慢性炎症、铁死亡与骨健康的关系
PD患者可能存在慢性炎症状态,而慢性炎症是加速骨质流失和促进骨脆性的重要因素。炎症环境可能通过多种机制干扰正常的骨重塑过程,导致骨质疏松的发展。Gao 等[24] 在实验中发现,骨骼中的 PGE2 浓度与机械负荷的变化成正比,而在成骨细胞谱系细胞中缺乏环氧合酶-2(COX2)或敲除感觉神经受体 4(EP4)会减弱机械负荷对骨形成的影响。这印证了近年来产生的“COX2 是压力敏感性基因”的观点,即机械牵拉、流体力、节律性液体流 (pulsating fluid flow,PFF)等机械刺激均能引起成骨细胞 COX-2 高水平表达[25]。这项研究强调了慢性炎症状态在PD患者骨质健康中的重要性。
值得一提的是,多项科学研究发现 PD 中存在一种称为铁死亡的细胞死亡方式,该死亡方式依赖于铁的存在,不同于细胞凋亡[26-27]。铁死亡在PD的发展中扮演了重要角色,铁代谢不仅与 OP 存在密切关系[28],还与其他多种骨科疾病相关。在铁超载刺激下,破骨细胞的骨吸收增强,超过新骨形成的速度,甚至可能导致病理性骨折[29-31]。日后,研究人员需要进一步探索铁代谢与骨健康之间复杂的相互作用机制,有望使调节铁代谢、抑制铁死亡成为一种新的骨科疾病和PD的治疗方式。
2.3 PD与骨骼肌的关系
PD 患者常见的肌肉僵硬和运动障碍不仅对其生活质量产生负面影响,还会间接影响骨骼健康。 PD患者的运动障碍和活动减少会导致肌肉萎缩,这会进一步降低机械负荷的作用[32]。PD 患者普遍存在骨骼肌肉疼痛,这种疼痛与运动负荷无关,而与多巴胺能耗竭的程度密切相关。深入了解帕金森病患者肌肉萎缩、运动障碍和骨骼肌肉疼痛的机制,有助于临床医生为患者制定更有效的康复计划和疼痛管理策略,改善他们的生活质量。
3 帕金森病和骨骼系统相关的生化与分子机制
作为一种代表性的神经退行性疾病,PD与骨代谢紊乱之间的联系是近年来骨骼病理学领域的一个重要研究方向。这种联系揭示了一系列复杂的生化和分子机制,它们共同作用于神经系统和骨骼系统,导致OP和其他骨骼健康问题的发生。
3.1 神经-骨代谢轴的调控机制
PD 等神经退行性疾病患者表现出的运动障碍与OP之间的关联可能源于神经-骨代谢轴的失调。该轴包括中枢神经系统、周围神经系统以及骨骼组织,通过神经传导、细胞因子和激素等多种机制发生相互作用。近年来,下丘脑-垂体-肾上腺轴 (HPA 轴)失调在 PD 中的作用也有一定的研究进展。研究人员通过 PubMed 和 Embase 数据库进行系统分析,结果表明皮质醇水平与帕金森病症状之间可能存在关系,提示 PD 患者存在与皮质醇水平相关的HPA轴功能障碍[33]。
调节骨代谢的中枢因子包括由 36 个氨基酸残基组成的神经肽 Y(NPY)、5-羟色胺、内源性大麻素、可卡因、脂联素等,它们控制了成骨细胞和破骨细胞的分化、增殖和功能[34]。研究表明,多巴胺能通过其受体直接影响成骨细胞和破骨细胞的活动,影响骨密度和骨质状况[35]。这提示通过深入研究神经-骨代谢轴有助于揭示 PD 患者运动障碍和骨质疏松之间的复杂关系。
3.2 氧化应激对骨代谢的作用
PD的另一个关键特征是氧化应激,通过活性氧 (ROS)的产生影响骨代谢,并进一步加剧骨质流失[36]。这些过量的 ROS随着年龄增长而增加,导致氧化还原失衡,加重PD的神经毒性。
近年来,越来越多的证据表明由 NADPH 氧化酶(NOX)产生的 ROS,尤其是 NOX4,在 PD 的发展中扮演着关键角色。研究发现,NOX4 的活化通过引发线粒体功能障碍来调节星形胶质细胞的铁死亡[37]。NOX4 与海马中的 MPO 和骨桥蛋白(OPN) 存在直接相关性,MPO 和 OPN 上调诱导线粒体功能障碍从而导致人星形胶质细胞发生铁死亡[38]。另外,OPN 不但与多种骨相关疾病的发生、发展密切相关,同时也在神经元的炎症和退行性机制中也起着重要作用[39]。
氧化应激与骨代谢和 PD之间存在复杂的相互关系,但对于这些关系的具体机制还需要进一步的研究来阐明,以便研发更有效的干预措施和个性化治疗策略。
4 遗传学上帕金森病与骨骼系统的关系
根据相关的流行病学研究显示,PD与神经毒素或病毒感染等环境因素存在关联。例如,使用 1-甲基-4-苯基-1,2,5,6-四氢吡啶(MPTP)的吸毒者表现出类似 PD 的症状,而大流行性流感病毒与脑炎后 PD密切相关[40]。目前已经发现超过 20个常染色体显性和隐性遗传突变与PD的发病机制相关。
PD患者中的许多遗传突变不仅影响PD的脑病理学变化,还对骨代谢产生调节作用。如 PARKIN 缺陷小鼠在铝暴露下表现出加重的骨损伤、线粒体损伤和氧化应激[41];PARKIN 的上调可以促进 β-连环蛋白的表达和自噬,增强骨特异性标志物的表达[42];研究还显示 P53 和 PARKIN 共同调节骨髓间充质干细胞的线粒体自噬,促进早期类固醇诱导的股骨头坏死的修复[43]。而 PARK7 与常染色体隐性 PD 的早期发作有关[44],外源应用 PARK7 可以促进骨折修复模型中的血管和新骨形成,从而促进骨再生[45]。α-SYN 由 SNCA 基因编码,是帕金森病患者路易体包涵体的主要成分,SNCA 能够调节晚期骨网稳态和卵巢切除引起的骨丢失[46]。考虑到目前已发现许多 PD 风险基因直接参与骨重塑的调节,进一步研究可能揭示 PD临床诊断和治疗策略发展的新见解。
骨关节炎(OA)也和 PD 存在关联,然而关于这两种疾病之间特殊相互作用的完整研究还不充分。研究人员通过基因角色塑造和功能富集两个层面来探索这种关系。他们的研究共鉴定出 71 个共同的基因,其中大多数功能富集在抗原加工和呈递、线粒体翻译、mRNA监视通路和核质转运等功能通路[47]。Ma等[48] 通过生物信息学和有序 Logit模型分析揭示了帕金森病和骨质疏松症之间的临床和遗传相关性,结果显示 PD 的诊断是骨质疏松症的独立危险因素,PD 患者发生 OP的风险约为正常人的两倍。
这些研究通过多种分析方法和数据库资源,揭示了 OA、OP 与 PD 之间的相关性,并挖掘出一些具有潜在诊断和治疗价值的基因(见表1),为深入研究和理解这些疾病的共同机制提供了重要线索。
表1骨代谢相关细胞因子、蛋白或基因影响帕金森病的作用机理
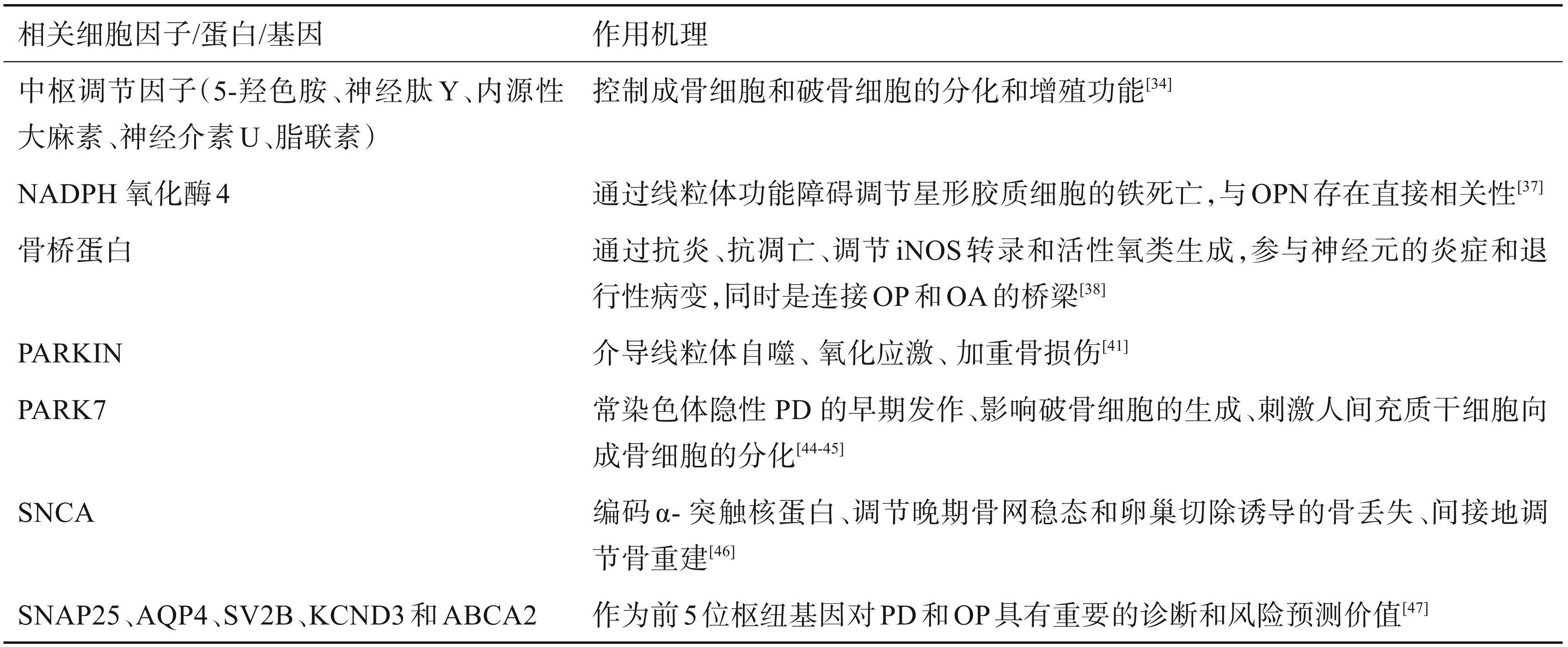
5 小结
PD患者的骨流失是多种因素相互作用的结果。 PD患者的骨密度降低与多种原因有关,包括神经骨代谢轴失调、运动能力下降、维生素 D缺乏、高同型半胱氨酸血症(由于左旋多巴、维生素 B12或叶酸缺乏引起)、营养不良、低身体质量以及肌肉力量减弱等,这些因素在 PD 中普遍存在且协同作用。PD 患者目前没有进行 OP 的常规筛查,但鉴于他们的骨折发生率较高,对其进行细致的管理和全面的风险评估,包括药物使用、运动水平、肌肉力量和营养状况等至关重要。此外,PD 和 OP的风险基因可能涉及相似的致病机制,这提示我们重视遗传因素并进一步研究这些基因在骨骼中的作用可能有助于开发同时治疗帕金森病和骨质疏松症的新靶向药物。PD 与骨骼系统的相互作用涉及多种途径和病理过程,我们目前还知之甚少,目前研究表明联合疗法能够最全面的保护 PD 患者骨健康,需要为不同体能的患者制定个性化干预与治疗措施。总之,关于 PD 与骨骼系统的相互关系亟待进一步研究,从而为临床治疗提供更多的手段。
