摘要
目的 探讨壳聚糖(CS)和芍药苷(PF)及其联合应用对高脂饮食诱导的非酒精性脂肪肝病(NAFLD) 小鼠脂质代谢的影响。方法 选取 6 周龄雄性 C57BL/6 小鼠 30 只,随机分为空白对照组(Ctrl 组)、高脂饮食组 (HFD 组)、CS 组[CS 50 mg/(kg·d)]、PF 组[PF 50 mg/(kg·d)]和 CS+PF 组[CS 和 PF 各 25 mg/(kg·d)],每组 6 只。连续8周高脂饮食建立NAFLD模型,随后通过灌胃给予相应处理,Ctrl组和HFD组给予等体积0.9%生理盐水。每 3 天测量 1 次身体质量,8 周后处死小鼠,比较各组的身体质量变化,并检测血清谷丙转氨酶(ALT)和谷草转氨酶 (AST)水平及肝脏脂肪质量。采用 HE染色观察肝脏和腹部脂肪的病理变化。结果 与 Ctrl组相比,HFD组小鼠身体质量、腹部脂肪质量均显著增加(P<0.0001)。CS+PF联合治疗显著减轻了小鼠的身体质量和腹部脂肪质量 (P<0.0001),且减轻小鼠身体质量的效果优于单独使用 CS或 PF(P<0.0001);与 Ctrl组相比,HFD 组小鼠的血清 ALT 和 AST 水平显著上升(P<0.05)。CS、PF 及 CS+PF 组的 ALT 和 AST 水平与 Ctrl 组相比差异无统计学意义 (P>0.05)。各组间肝脏指数(肝脏质量/身体质量)比较差异无统计学意义(P>0.05)。结论 CS和PF联合使用能显著改善NAFLD小鼠的脂质代谢。
Abstract
Objective To investigate the effects of chitosan (CS) and paeoniflorin (PF) on lipid metabolism in high-fat diet-induced nonalcoholic fatty liver disease (NAFLD) mice. Methods A total of 306-week-old male C57BL/6 mice were randomly divided into blank Control group (Ctrl group), high-fat diet group (HFD group), CS group [CS 50 mg/(kg·d)], PF group [PF 50 mg/(kg·d)]and CS +PF group [CS and PF 25 mg/(kg·d) each], with 6 mice in each group. The NAFLD model was established on a high-fat diet for 8 consecutive weeks, and then the corresponding treatment was administered by gavage. The normal diet group and the high-fat diet group were given the same volume of 0.9% normal saline. Body mass and food intake were measured every 3 days, and mice were sacrificed 8 weeks later. Body mass changes were compared between groups, and serum alanine aminotransferase (ALT) and aspartate aminotransferase (AST) levels and liver fat weight were measured. Hematoxylin and eosin (HE) staining was used to observe the pathological changes in the liver and abdominal fat. Results Compared with the Ctrl group, the body weight and abdominal fat weight of the mice in the HFD group were significantly increased (P<0.0001). CS +PF combined treatment significantly reduced both the body weight and abdominal fat weight of mice (P<0.0001), and the effect on body weight reduction was greater than that of CS or PF alone (P<0.0001). Additionally, the serum levels of ALT and AST in the HFD group were significantly increased compared with the Ctrl group (P<0.05). There was no significant difference in the levels of ALT and AST among the CS, PF, and CS +PF groups compared to the Ctrl group (P>0.05). There was no significant difference in liver index (liver weight/body weight) between groups (P>0.05). Conclusion The combined use of CS and PF can significantly improve lipid metabolism and reduce the accumulation of abdominal fat in NAFLD mice.
Keywords
随着生活标准的提升,人类饮食习惯趋向高糖高脂,导致肥胖及相关健康问题日益增多。非酒精性脂肪肝(NAFLD)是一种与高脂饮食直接相关的肝脏疾病,其特征是肝细胞内脂肪过度积累,且不涉及酒精滥用或其他已知的肝损伤因素[1]。NAFLD已成为全球最普遍的慢性肝病之一,西方国家的发病率约25%,而在中国,这一数字也在逐年上升[2-3]。尽管改变生活方式和调整饮食结构(如增加运动和节食)是 NAFLD的首选治疗策略,但对于病情严重的患者,药物治疗显得尤为重要[4]。若NAFLD在早期未得到有效干预,患者可能会从单纯的脂肪肝发展为更严重的非酒精性脂肪性肝炎、肝硬化甚至肝癌[5]。尽管许多NAFLD患者的病情进展缓慢,但若合并其他疾病,如二型糖尿病,其肝脏病变的进程可能会加速[6]。NAFLD的治疗药物包括水飞蓟素、蛋氨酸、柚皮素、白藜芦醇、雷公藤红素、双环醇、甘草酸二铵和熊去氧胆酸等[7]。研究发现,芍药苷(PF) 除了对脑血管、中枢神经系统、抗肿瘤和免疫调节等有积极作用外,还具有降血糖和保肝效果,能够促进脂肪细胞释放腺苷,从而改善糖代谢[8]。因此,PF在 NAFLD 治疗中显示出潜在的应用价值。然而,PF 的生物利用度较低,需要较高剂量才能发挥治疗效果[8]。鉴于此,研究者考虑将其与壳聚糖(CS)联合使用。CS是一种多功能的天然高分子生物聚合物,具有生物相容性、免疫刺激、生物可降解性和抗菌活性,在生物医学领域有广泛应用[9-11]。在畜牧业中,壳聚糖已大量用于促进动物免疫器官的发育,改善肠道微生物群落结构,减少腹泻和疾病的发病率[12]。此外,壳聚糖还能显著减少食物中脂质和胆固醇的吸收,有效减轻小鼠的高血脂和脂肪肝症状[13-14]。本研究通过高脂饮食诱导构建NAFLD小鼠模型,探讨 CS和PF联用对NAFLD小鼠脂质代谢的影响,以期为NAFLD的临床治疗提供参考。
1 材料和方法
1.1 实验动物
30 只 6 周龄的 SPF 级雄性 C57BL/6J 小鼠购自辽宁长生生物技术股份有限公司[许可证号:SCXK (辽)2020-0001]。小鼠在 SPF级动物房中适应性喂养 1 周,平均身体质量为(18.8±1.0)g。实验期间,小鼠分笼饲养,自由进食饮水,并维持 12 h/12 h 的光/暗周期。环境温度和湿度分别控制在(25±1)℃ 和 30%~40%。所有实验操作遵循国家卫生研究院实验动物福利和使用指南。本研究经广东医科大学实验动物伦理委员会批准(GDMU-2023-000030)。
1.2 试剂与仪器
实验所用的高脂饲料(D12492)来源于广东省医学实验动物中心,普通饲料由广州市研成生物科技有限公司提供。PF和CS分别购自上海麦克林生化科技股份有限公司和上海懋康生物科技有限公司。谷丙转氨酶(ALT)和谷草转氨酶(AST)试剂盒由南京建成生物工程研究所供应。实验中使用的仪器包括美国BIOTEK公司的多功能酶标仪和德国 Leica公司的荧光显微镜。
1.3 实验方法
1.3.1 分组与给药
6 周龄的雄性C57BL/6小鼠在适应性喂养1周后,随机分为4组:空白对照组(Ctrl组)、高脂饮食组(HFD 组)、CS 组[CS 50 mg/(kg·d)]、PF 组 [PF50 mg/(kg·d)] 以及 CS+PF 组 [CS 和 PF 各 25 mg/(kg·d)],每组 6 只。小鼠每日通过灌胃给予相应处理,连续8周。
1.3.2 实验小鼠组织取材
实验前夜18:00起,所有小鼠禁食但可自由饮水。实验当天,小鼠经戊巴比妥钠麻醉后,通过眼球采血并收集血清,断头处死,取出肝脏、脾脏和腹部脂肪组织,称质量后部分组织浸泡于中性组织固定液中。
1.3.3 HE 染色观察肝脏和脂肪组织切片
组织固定 24 h后,经过梯度酒精脱水、二甲苯透明、石蜡包埋、切片,进行HE染色。染色步骤包括苏木素染细胞核和伊红染细胞质,脱水封片,显微镜下观察。
1.3.4 观察指标
每 3 天测量 1 次身体质量,8 周后处死小鼠,比较各组的身体质量变化,同时检测 ALT 和 AST 水平及腹部脂肪质量、脂肪指数(脂肪质量/身体质量)、肝脏质量、肝脏指数(肝脏质量/身体质量)、脾脏指数(脾脏质量/身体质量)等。
1.4 统计学处理
采用 SPSS 20.0 软件进行数据分析,计量资料以表示,采用单因素方差分析及q检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 小鼠末次身体质量的比较
图1所示,HFD 组小鼠的末次身体质量显著高于 Ctrl 组(P<0.000 1),表明肥胖模型构建成功。 CS、PF、CS+PF 组与 HFD 组相比,均能显著抑制身体质量的增长(P<0.000 1),且CS+PF组效果最好,小鼠身体质量降低幅度超过 25%,表明 CS 和 PF 的联合应用在抑制高脂饮食引起的身体质量增加方面具有更好的效果。
2.2 肝脏质量分析
图2单独使用CS、PF及联合使用CS和PF对降低肝脏质量的效果不明显,差异无统计学意义(P>0.05)。因此,CS和 PF的联合使用在抑制非酒精性脂肪肝小鼠肝脏脂质积累方面表现的效果并不是很明显。
2.3 腹部脂肪质量分析
图3显示,与 HFD 组相比,CS、PF 及 CS+PF 组均显著降低了小鼠腹部脂肪质量(P<0.000 1),腹部脂肪质量的降幅超过 60%。结果表明,CS 和 PF 无论是单独使用还是联合应用在减少高脂饮食引起的腹部脂肪积累方面均具有良好的效果。
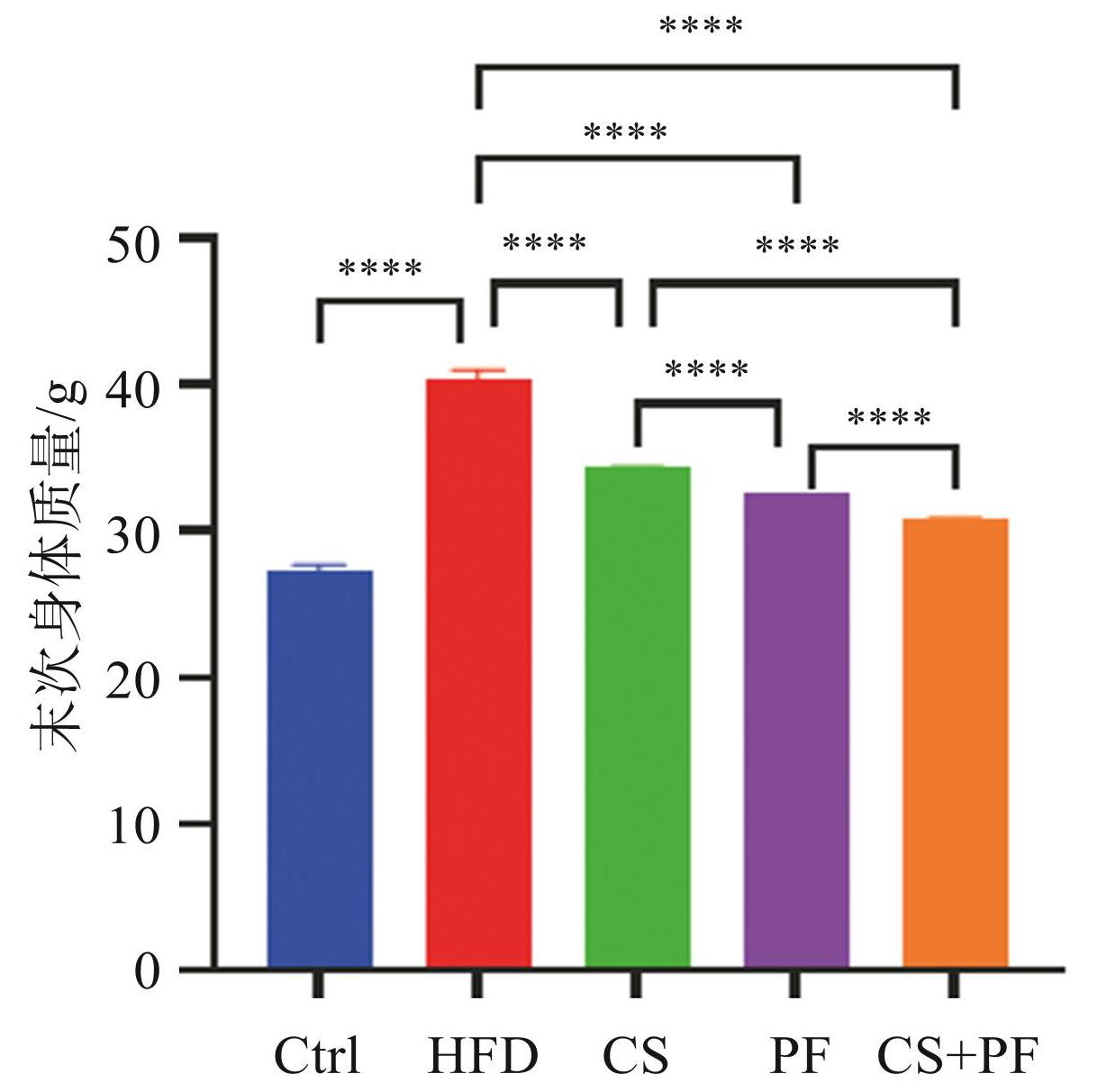
图1各组小鼠末次身体质量的比较(****P <0.000 1)
2.4 脾脏质量分析
图4显示,HFD 和 CS组小鼠的脾脏质量与 Ctrl 组相比差异无统计学意义(P>0.05),而 PF 组的脾脏质量高于 Ctrl组(P<0.05)。CS与 PF的联合使用在减半剂量的情况下,脾脏指数与 Ctrl组相比没有显著升高(P>0.05)。

图2各组小鼠肝脏组织及指数的比较
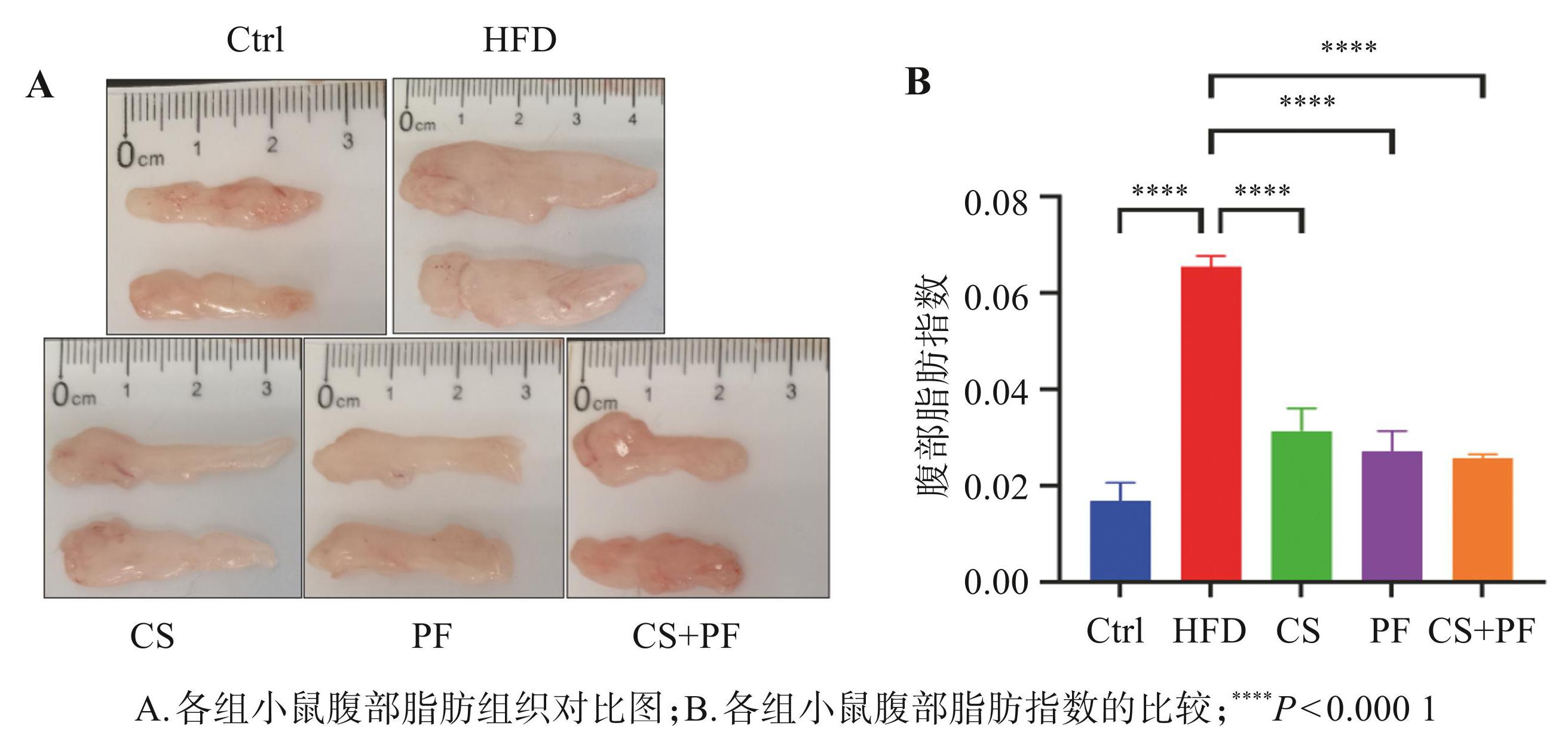
图3各组小鼠腹部脂肪组织及指数的比较
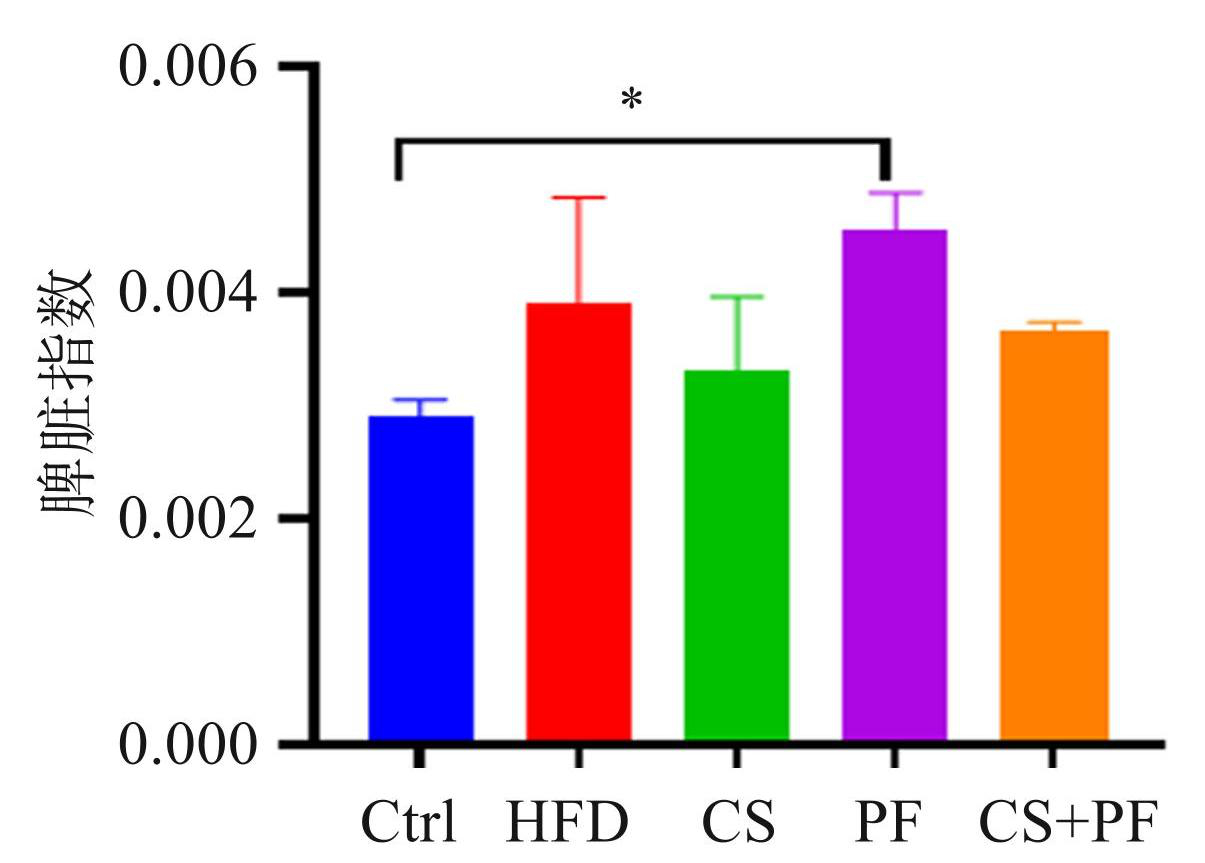
图4各组小鼠脾脏指数的比较(* P<0.05)
2.5 血清ALT和AST水平分析
如图5所示,与Ctrl组相比,HFD组小鼠的血清 ALT 和 AST 水平显著上升(P<0.05)。CS、PF 及 CS+PF 组的 ALT 和 AST 水平与 Ctrl 组相比差异无统计学意义(P>0.05),表明 CS 和 PF 的联合使用有效减轻了高脂饮食对小鼠肝脏的损伤,降低了血清中ALT和AST的水平。
2.6 肝脏组织HE染色观察
图6A的低倍镜观察(40×)显示,与Ctrl组相比, HFD组小鼠肝脏的脂肪细胞沉积显著增多,肝细胞内出现脂肪滴,肝细胞质内有空泡化,肝脏切片的HE 染色中的脂肪细胞直径明显增大;PF 和 CS+PF 组的脂肪细胞直径与 HFD 组比较降低了 50% 以上,判定非酒精性脂肪肝模型造模成功。图6B图所示,与HFD组比较,CS、PF及CS+PF组的肝脏脂质沉积得到改善,且 CS+PF 组效果更好(P<0.05 或 0.000 1),高倍镜观察(200×和 400×)进一步确认了低倍镜下的结果,显示CS+PF联合治疗在减少肝脏脂质沉积方面的优越性。
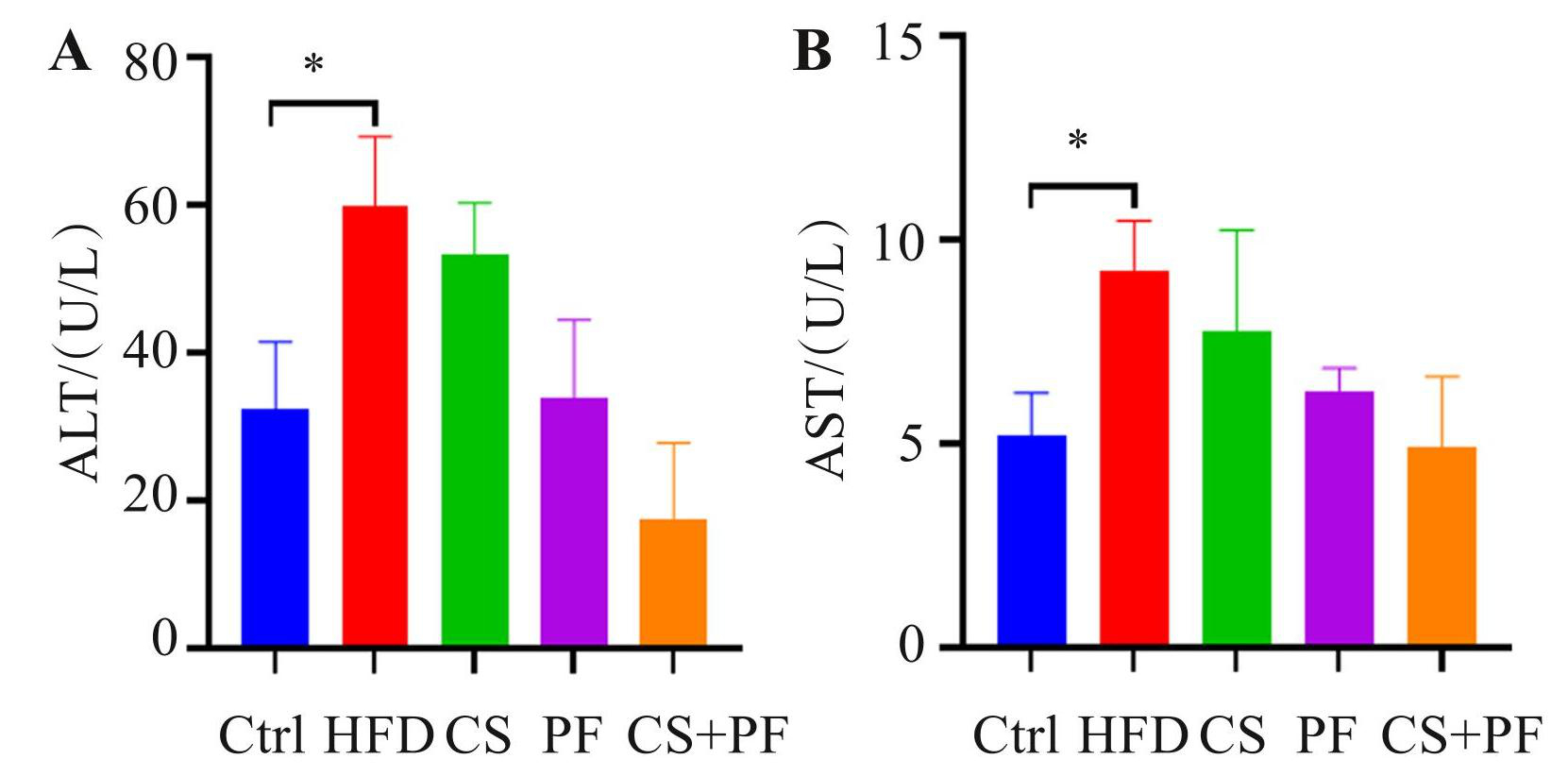
图5各组小鼠血清中ALT(A)和AST(B)含量的比较(* P<0.05)
2.7 腹部脂肪组织HE染色结果
与 HFD 组比较,CS、PF 及 CS+PF 组脂肪细胞平均脂滴直径明显降低,其中 CS+PF 组降低更显著(P<0.01),见图7。

图6各组处理的肝脏组织的病理切片分析

图7各组腹部脂肪组织的病理切片分析
3 讨论
NAFLD 是一种与胰岛素抵抗和遗传易感性紧密相关的代谢性肝病,其特征在于肝脏脂肪积聚而无大量饮酒。NAFLD 谱系从单纯的脂肪变性扩展至非酒精性脂肪性肝炎(NASH),并可能恶化为肝硬化和肝细胞癌。研究指出,调节脂质能量代谢是治疗 NAFLD 的关键策略[15]。 PF,一种从芍药 (Paeonia lactiflora Pall.)中提取的中药活性成分,已显示出对 NAFLD 的潜在治疗效用[16],如抗炎、抗氧化、改善胰岛素敏感性、调节脂质代谢、免疫调节等[17]。但是,PF 的生物利用度较低[18],因此在实际应用中可能需要与其他药物或治疗手段联合使用,以提高其治疗效果。
本研究通过高脂饮食成功建立了 NAFLD模型小鼠,探究了CS和PF联合治疗对NAFLD的潜在疗效。结果显示,与空白对照相比,高脂饮食小鼠的身体质量、腹部脂肪质量以及肝脏脂质累积方面均有显著增加。而经CS+PF联合治疗的小鼠,上述指标改善更显著,接近正常水平。AST和ALT是评估肝脏健康的关键指标[19],本研究通过检测 ALT 和 AST 水平发现,小鼠给予 CS 和 PF 干预对其肝脏功能没有明显的损伤;通过肝脏组织与腹部脂肪组织的HE染色切片观察也证实CS+PF联合使用具有更好的治疗效果。相比之下,单独使用 CS 或 PF 的治疗效果均不如联合治疗,但单独使用较高剂量的PF 会使小鼠脾脏指数增大,因此后续会进一步探究低剂量的PF对NAFLD小鼠脂质代谢的影响。综上所述,CS 和 PF 的联合应用相对 CS、PF 单独使用在改善 NAFLD模型小鼠的肝损伤和脂质积累方面具有更好的效果。鉴于 NAFLD全球流行趋势以及现有治疗手段的局限性,这种联合治疗策略为患者提供了新的希望。未来,研究将继续深入探讨 CS 和 PF 联合使用对脂质代谢途径的具体影响,以及它们如何协同作用以改善 NAFLD。此外,动物模型中进行长期毒性和安全性研究对于后续临床试验的开展具有至关重要的作用。






