摘要
骨关节炎(Osteoarthritis,OA)是一种严重危害人类健康的慢性关节病,其主要特点是关节软骨的进行性破坏。但因其自身软骨修复能力有限,至今仍缺乏有效的治疗手段。细胞旁分泌的外泌体(Exosomes,Exo),可参与多种细胞活动,对OA具有较好的疗效,然而单独使用天然外泌体治疗OA,面临着器官靶向性差、半衰期短、疗效不佳等问题。合理的预处理方式可增强外泌体的靶向、稳定及体内半衰期,从而达到治疗OA的目的。该文通过对提高外泌体OA疗效的预处理方法进行综述,以期为临床应用外泌体治疗OA提供参考。
Abstract
Osteoarthritis (OA) is a chronic joint disease that seriously jeopardizes human health , primarily characterized by progressive degradation of articular cartilage. However, there is still a lack of effective treatment due to its limited ability to repair cartilage. Paracellularly secreted exosomes , which can participate in a variety of cellular activities, have good therapeutic efficacy in OA. However, the use of natural exosomes alone in the treatment of OA faces problems such as poor joint targeting, short half-life, and poor therapeutic efficacy. A rational pretreatment approach can enhance the targeting, stabilization and in vivo half-life of exosomes for the treatment of OA. In this paper, we review the pre-treatment strategies aimed at enhancing the efficacy of exosomes for OA, in order to provide a scientific basis for the clinical application of exosomes in the treatment of OA.
Keywords
当前,针对骨关节炎(OA)的非手术疗法包括非药物干预措施(运动、减重及矫形)以及药物疗法(包括镇痛剂、非甾体类抗炎药以及关节内注射皮质类固醇或透明质酸等)。然而,这些疗法所能提供的即时缓解效果较为有限,且未能有效遏制软骨退行性病变的持续恶化。对于那些经非药物与药物疗法均未能获得满意疗效的患者而言,手术治疗成为了必要考量。
关节置换术治疗OA疗效显著,能够为患者带来显著的生活质量改善。然而,人工关节的使用寿命有限,通常在 15~20 a后可能需进行更换,这一因素限制了其在年轻患者群体中的广泛应用。因此,关节置换术通常被视为 65 岁及以上患者的优选治疗方案 [1]。在决策过程中,需综合考虑患者的年龄、病情严重程度及生活质量需求,以制定最为适宜的个性化治疗方案。
为填补传统治疗和手术治疗之间的空白,外泌体治疗是理想的选择。但天然来源的外泌体具有活性低、半衰期短、组织靶向性差等缺点,严重制约了其疗效及在实际的临床应用。目前,针对预处理提高外泌体疗效的研究有待深入探讨。本文就各种预处理方式对外泌体损伤修复的作用及对 OA疗效的影响做一综述,为进一步推动外泌体的临床转化提供参考。
1 外泌体的物质预搭载
外泌体是一种典型的双层磷脂双层结构,其在体内循环时能起到保护作用,作为一种新型的运输载体,可携带内源性炎症因子,并携带大量特异性膜蛋白,帮助其跨越生物屏障,靶向损伤部位。因此,外泌体可将核酸、中药成分、化学物等多种物质有效地输送到细胞内,具有良好的应用前景。外泌体的预搭载最重要的一步是在保持其结构完整的前提下,高效载药于外泌体中[2-3]。
目前,外泌体的预搭载可以简单地分为前装载和后装载[4]。前装载是将载体材料与亲本细胞进行共培养,将药物有效地摄入或转移到亲本细胞上,再由外泌体携带药物。前装载虽不影响其整体性,但载药效率低。后装载是指利用多种手段将药物负载于外泌体内。常用的后加载方法有自然孵育法、转染法、电穿孔法、超声载药法、冻融循环法、过表达法、挤压法等。后装载可以提高外泌体的药物负载效率,但某些方法可能会破坏外泌体膜完整性,从而影响药物的活性。不同的载药方式各有利弊,适用的对象也不同。下面对常见的后装载方法进行归纳[5-6],见表1。
目前在外泌体治疗OA领域,关于外泌体搭载中药成分或化学药物的研究较少,一般通过对源性细胞转染非编码RNA,收集高表达某种非编码RNA的外泌体,从而达到对OA的精准干预。
1.1 外泌体预载药物
1.1.1 预载小分子中药提取物
以外泌体为载体,实现对中药活性组分的精准转运和靶向治疗,降低毒副作用,已成为研究热点。廖太阳等[7]以“柔肝养筋” 为代表的木瓜为研究对象,将木瓜与肝细胞共培养上清液中所收集的外泌体干预LPS致炎的软骨细胞,可抑制 LPS 诱导所致的促凋亡蛋白 Bax、Caspase-3 和Caspase-9 表达水平的上升,同时升高抗凋亡蛋白 Bcl-2 的表达,减少软骨细胞凋亡,从而发挥保护软骨细胞的功效。张力等[8]以此为切入点,以具有“柔肝养筋”作用的中药复方白芍为研究对象,研究其对致炎软骨细胞的调控作用,并发现其干预后,软骨细胞外泌体可下调MMP3、MMP13、SOX9、ADAMTS5 等基因及蛋白表达。马笃军等[9]将牛膝醇提取液与 BMSCs 共培养,并提取含有牛膝的外泌体,观察其对家兔 OA 模型大鼠关节软骨的超微结构和炎性小体的作用,发现其可减轻 OA大鼠的炎性反应,减轻关节粘连程度。牛膝提取物还可通过调控滑膜成纤维细胞分泌的外泌体,减轻 OA兔膝关节活动性,减少关节滑膜组织中 MMPs的表达,增加 GPC含量,减少 ECM降解,起到保护关节软骨的作用[10]。
中药提取物与外泌体的关系主要有 3 种:中药提取物介导外泌体内容物含量改变;中药提取物引起外泌体结构变化;外泌体作为中草药的药物载体[11]。然而目前对于这 3 种关系研究还不透彻,其中存在的机制也并不完全明了,还需要更进一步的研究。
1.1.2 预载化学药物
Kartogenin (KGN)是于 2012 年首次报道的具有重要生物活性的杂环小分子,具有重要的临床意义。KGN是近年发展起来的一种新型组织工程学方法,它为关节软骨的再生与修复开辟了新途径。Liu等[12]将 KGN与 BMSCs共培养,获得特异性外泌体。前期研究显示,KGN-BMSC-Exo 和 BMSC-Exo都能促进软骨细胞向软骨分化,其中KGN-BMSC-Exo效果更好。进一步研究发现,KGN-BMSC-Exo 能有效抑制 BMSC-Exo 诱导的软骨细胞 RunX1表达,还能显著提高 BMSCs的成骨分化能力,抑制 COLI 表达。在此基础上,Cai 等 [13] 研究表明,KGN-Exo能够更好地促进软骨细胞的分化,促进胶原的成熟,促进组织再生。Shao等[14]研究显示,从经 KGN 预处理的髌下脂肪垫间充质干细胞中分离的外泌体具有诱导干细胞软骨形成分化的强能力,有效促进软骨形成蛋白和软骨细胞基因的增殖和表达。樊逸菲等[15]利用小分子药物天然二羟基苯内酯(5Z-7)与小鼠胚胎肿瘤成软骨细胞来源的外泌体共同培养,制备载药外泌体,体内外实验证明其具有改善骨关节炎表型的作用。另外,利用外泌体包裹 5Z-7,降低了给药剂量及给药次数,并与外泌体进行“叠加”治疗,提高了OA疗效。
表1外泌体常见后装载方法

1.2 外泌体预载核酸类物质
近年来,高通量测序技术的发展,已有研究证实核酸类物质与骨关节炎密切相关。非编码 RNA (non-coding RNA)是一类非编码 RNA,它并不直接参与蛋白的编码,但是在调控基因表达方面发挥着关键作用。其在OA中发挥重要作用,已成为 OA治疗的新靶标。外泌体中含有大量非编码 RNA,如 miRNA、 circRNA、 siRNA和 LncRNA等,可介导细胞之间的信息交流,并调控其在胞内的表达[16]。通过前装载或后装载技术,构建富含特异性非编码 RNA的外泌体,从而增强其对骨关节炎的治疗作用。
1.2.1 预载 miRNA
miRNA 是内源性小非编码 RNA,长度为 20~22 个核苷酸。在许多情况下,miRNA 与信使RNA(mRNA)的 3/非翻译区(UTRs)结合,导致翻译抑制或靶 mRNA 降解,从而影响疾病发生发展[17]。目前,在关于外泌体的预处理措施研究中,绝大多数通过高表达某种 miRNA 来实现在骨关节炎中的疗效优化,主要涉及的 miRNA 为 miR-140-5p、miR-92a-3p、mir-155-5p、miR-214-3p、miR-95-5p、miR-486-5p、miR-338-3p、miR-100-5p、miRNA-27b等。
Lin等[18]将miR-140-5p模拟物导入牙髓干细胞,发现其外泌体装载miR-140-5p,牙髓干细胞分泌的外泌体可显著上调 Aggrecan、Col2α1 及 Sox9 等蛋白,且富含miR-140-5p的外泌体对其影响更显著,提示富含miR-140-5p的外泌体可明显抑制软骨细胞凋亡,其机制可能与调控凋亡相关蛋白的表达有关。类似的,人尿液来源的干细胞(husc)过表达miR-140-5p的外泌体治疗骨关节炎方面优于hUSC-Exos,作用部分是由VEGFA介导的[19]。外泌体预载 miRNA 在骨关节炎中得到了广泛的研究,现将其余外泌体过表达特定 miRNA治疗脊骨关节炎的机制归纳如下,见表2。
1.2.2 预载circRNA
circRNA是一类不具有 5’末端帽子和 3’末端poly(A)尾巴、并以共价键形成环形结构的非编码RNA分子。它们由前体mRNA的反剪产生,并在高度保守、稳定和组织特异性的哺乳动物中广泛表达。最近的研究表明,circRNA可以竞争性地相互作用并抑制miRNA海绵在其下游功能中的[28]。但外泌体中携带 circRNA 与骨关节炎关系的研究鲜有报道。Mao等[29]研究结果显示,过表达 MSC 的来源 circRNA_0001236 外泌体显着上调 Col2a1 和 Sox9 的蛋白表达水平,抑制了软骨细胞的变性并延缓了 OA 进程。
1.2.3 预载siRNA
siRNA是一种小分子RNA,可以通过靶向特定基因的mRNA,导致该基因的沉默和抑制,在骨关节炎领域有广阔前景。但siRNA存在传递效率低、性质不稳定、易刺激免疫系统等问题,因此选择合适的递送载体至关重要 [30]。外泌体具备低免疫原性、良好穿透性及循环稳定性等优势,是siRNA递送的可靠载体。厉玲玲等[31]以Piezo1 为靶基因进行 siRNA 沉默处理,通过慢病毒转染BMSCs,从细胞层面验证siRNA-Piezo1 沉默质粒转染 BMSCs后可以促进 BMSCs向软骨细胞分化。此外,还构建了OA动物模型,提取siRNA-Piezo1 处理BMSCs来源的外泌体,从动物层面验证其对OA动物模型有修复作用。具体机制可能是阻断 Piezo1 表达后,下调了ERK、Caspase 信号通路介导的软骨细胞凋亡。
表2外泌体过表达不同 miRNA 在骨关节炎中的作用机制

1.2.4 预载 LncRNA
LncRNA 是一种超过 200 个核苷酸的非编码转录物,在骨关节炎的发展过程中, LncRNA可以通过招募相关蛋白调控基因转录、参与调控细胞通路、作为竞争性内源RNA靶向相关miRNA 或直接靶向 mRNA 等方式发挥调控作用 [32-33]。 Bai 等 [34] 证实过表达外泌体 MM2P 阻止了 SHP2 介导的 STAT3 在 Try705 处的去磷酸化,并促进 Sox9、 Col1a2、 Acan的表达,增加胞外基质组分(如蛋白聚糖、胶原)的分泌,从而促进软骨细胞的分化与功能。
1.2.5 外泌体预载蛋白质
外泌体既能装载药物和核酸,又能装载蛋白药物,从而提高其在OA中的疗效。软骨调节蛋白-1 (Chm-1)是一种在软骨组织中高表达的蛋白,它可以抑制软骨细胞的肥大,抑制骨关节炎的进展,在骨关节炎的发病过程中起到了关键作用。Chm-1-Exos 上调 Collagen II、SOX9、 AGG 蛋白及 mRNA 的表达,并可明显促进 OA 软骨细胞增殖 [35]。 Liang 等 [36-37] 利用基因融合技术,将外泌体上的Lamp2b与软骨细胞亲和多肽(CAP)相结合,制备成软骨细胞靶向外泌体(CAP-Exo),发现 CAP-Exo与脂质体相结合,构建杂合的CAP-Exo,可包载 CRISPR/Cas9 质粒、miR140,并能抑制软骨降解,缓解或缓解关节软骨退变。Lu等[38]将 TGFβ3/BMP6 导入 ADSCs,使其在 ADSCs中稳定表达,促进软骨组织发育、分化及力学性能。为证实这一假说, Cosenza 等 [39] 通过筛选出负载 TGFβ3/BMP6 的 BMSCs 外泌体,证实其可促进OA发生发展。因此提出“MSCs源性外泌体联合 TGFβ3、BMP6 诱导成骨分化潜能”的新思路,有望为 OA的防治提供新思路。在此基础上, CKExogene也按照相似思路,提出了以外泌体为载体的 OA靶向治疗方案,以外泌体为载药载体,联合过表达 TGFβ3/BMP6,构建OA靶向治疗新策略(图1)。
蛋白类药物是目前治疗骨关节炎的重要手段,但因其分子量大、体内稳定性低等缺点,限制了其临床应用。为解决上述问题,研究者们开始研究利用外泌体装载蛋白的方法,以期在维持其生物稳定性的前提下,达到靶向递送的目的。通过对外泌体进行基因修饰,并装载多种蛋白,从而得到靶向外泌体,从而达到精准的药物递送,可望降低非靶器官的毒副作用,是今后发展的重要发展趋势。
2 外泌体联合生物材料
尽管外泌体对OA具有良好的治疗效果,但其临床应用仍有待深入。将外泌体注射至骨-软骨界面是实现外泌体递送至目标位点最直接的途径。然而,由于其在体内不能及时释放、不易扩散,故需多次注射才能维持其临床疗效,且易造成感染,因此,目前以外泌体为载体的骨软骨损伤修复研究面临诸多挑战。为此,将外泌体与生物材料复合,构建高效的外泌体递送体系,实现外泌体的持续稳定释放,解决目前外泌体稳定性差、滞留难等问题,使外泌体的疗效最大化[40]。
2.1 天然生物材料
Chen 等 [41] 利用光刻方法制备了三维打印的 ECM/明胶/Exo复合支架,发现通过缓释外泌体,可将 MSCs分泌的外泌体导入到软骨细胞中,实现软骨细胞向缺损区的迁移。同时,通过对外泌体中线粒体相关蛋白的补充,促进线粒体生成,修复受损的软骨细胞,达到修复骨软骨损伤的目的。光诱导亚胺交联的水凝胶作为外泌体的支架材料,可对软骨细胞及 BMSCs进行正向调控,并与自身软骨基质结合,促进细胞在损伤处的沉积,从而达到修复软骨的目的[42]。透明质酸(HA)有高黏度特性,将其注入关节腔内,使其能够在 12 周内完成对关节软骨的修复[43]。Hu等[44] 将甲基丙烯酸明胶(GelMA)/纳米黏土层(GelMA)复合水凝胶(gel-nano),负载 hUMSCs 来源外泌体,具有较好的生物相容性及机械强度。该凝胶具有可注射、紫外光固化等优点,可用于修复未成形的软骨缺损,在支架材料降解的同时,外泌体能够持续释放,从而达到修复关节软骨的目的。人沃顿胶 MSCs分泌的外泌体具有协同强化去细胞化软骨 ECM的作用,从而促进骨和软骨的修复[45]。景雷等[46]将 BMSCs源性外泌体与丝素材料复合,构建丝素蛋白支架联合外泌体复合物,可显著改善软骨缺损。现将外泌体联合天然生物材料治疗OA的相关研究加以汇总,见表3。
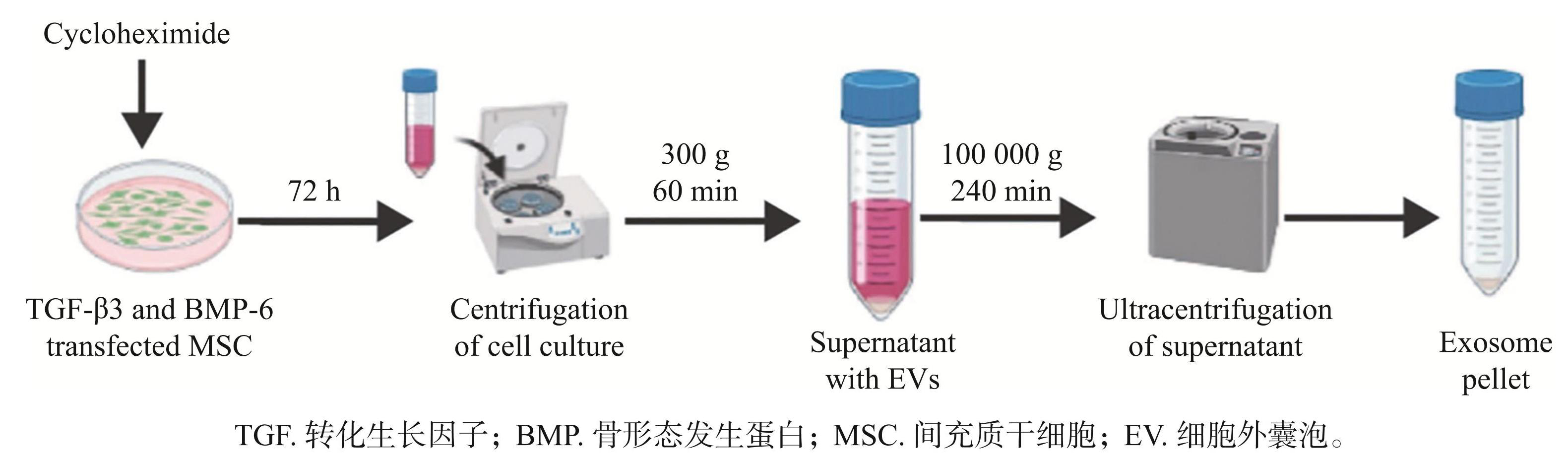
图1基于超速离心的外泌体分离示意图
2.2 合成材料
大多数全关节置换假体都是由钛制成的。纯钛和钛合金由于其优良的生物相容性和力学性能[47],是临床应用最广泛的支架之一。由于相对生物惰性,许多技术,包括物理和化学处理,已被应用于修饰钛表面[48]。这种表面修饰技术和钛支架上的微纹理变化,提供了不同的微环境,可以促进组织和植入物之间的基本相互作用,改善钛植入物的生物功能[49]。Wei 等[50]利用钛纳米管封装BMP2 诱导巨噬细胞分泌的外泌体,发现其可抑制外泌体释放。BMP2-巨噬细胞源性外泌体可上调成骨分化相关分子 ALP、BMP2 的表达,促进BMSCs成骨分化时,自噬被激活,细胞因子的分泌也发生改变。另外, Wang等[51]发现来源于 MSC 并固定在钛盘表面的外泌体可迅速促进 MSC 粘附和增殖,上调SDF-1α、外泌体中粘附相关分子及信号分子表达。这些发现为钛植入物改性提供了新的途径。以聚乙二醇(PEG)和聚乳酸-羟基乳酸共聚物 (PLGA)制备PLGA-PEG三嵌段共聚物微球,该复合微球是将 PLGA和 PEG两种高分子模块结合在一起,分别用于制备生物相容性好、可降解的高分子模块,聚乙二醇可提高微球的稳定性,调节微球的表面特性,提高其抗吸附能力。PLGA-PEG三嵌段共聚物具有缓释功能,可调控高分子微球外泌体的释放,增强 BMSCs 的分化与矿化,招募内源性细胞至缺损处,促进其分化[52]。将聚多巴胺(PDA)包覆于 PLGA基底表面,并负载ADSCs分泌的外泌体(PLGA/PDA),PLGA/PDA 可通过自组装的方式将外泌体缓释到 PLGA/PDA支架内,并促进其成骨分化[53]。现将外泌体联合合成材料治疗OA的相关研究加以汇总,见表4。
生物材料结合外泌体是一种新型的治疗方法,可在 OA组织中填充 ECM,为细胞提供支撑,从而加速损伤修复。将外泌体与生物材料相结合,构筑一种新型的药物传递体系,以期实现外泌体的靶向输送、缓释及长效治疗。在这些研究中,最重要的是如何选用合适的生物材料。天然或人造的生物材料都有各自的优点,也有其局限性。天然高分子材料生物相容性好,无毒副作用,但存在塑性差,机械强度低,结构不稳定等不足;而人工合成的高分子材料具有塑性好、力学性质可调、降解速度快等优点,但其与细胞亲和性差,易出现毒副作用。因此,寻求一种能够将二者优势结合起来的新型复合材料,是一种理想的选择。
表3外泌体联合天然生物材料治疗OA的相关研究汇总

表4外泌体联合合成材料治疗OA的相关研究汇总

3 总结与展望
近年来,随着对外泌体在 OA中的研究越来越多,其在 OA中的作用也逐渐被揭示。前期研究发现,多种细胞源性外泌体可抑制炎症反应,促进软骨细胞增殖,抑制细胞凋亡,调控细胞外基质的分泌,从而促进 OA 的修复。但自然界中的外泌体具有半衰期短、靶向性差、疗效不佳等缺点。为了优化外泌体在OA损伤修复中的作用,可采取以下方法:(1)通过多种装载模式,装载小分子药物、核酸类物质、蛋白等物质,构建外泌体物质输送体系,装载物质至受损区域,增强外泌体的治疗效果,达到精确干预损伤机理。(2)将外泌体和生物材料结合,构建新型的外泌体运输模式,在对缺损区提供力学支持的情况下,实现外泌体的长效、稳定释放。
但现有的预处理研究大多局限于细胞和动物水平,所采用的预处理方法虽已获得较好的结果,但与临床应用要求还有很大差距,其原因在于:(1)预处理不良反应机制不明,且存在潜在的安全性隐患;(2)对某些预处理的机理研究太少,甚至不清楚;(3)目前缺乏制备前预处理外泌体的标准化和可实施性,无法实现大规模制备。
因此,要想进入临床试验甚至研究转化,首先要解决的是特定外源分子的植入、生物材料联用等预处理方法,能否使外泌体的生物学性质发生改变,从而增加其免疫原性和毒性。然而,由于外泌体成分复杂,现有的研究多集中于单个成分的单一功能,但其作用与各种分子有关,因此仍需揭示更多高度复杂和交叉的分子通路,全面阐明外泌体在OA的治疗机制。另外,由于外泌体的异质性,其制备工艺的标准化亟待研究,在制备、分离、表征、贮存等方面,必须建立统一的安全与疗效评估体系,同时也要求制定合理的用药策略,充分发挥外泌体优异的组织工程潜力,力争尽早将外泌体应用于OA的临床转化,为OA的治疗开辟新途径。




