摘要
目的 应用奥沙利铂联合X射线照射建立小鼠再生障碍性贫血模型。方法 将 10 只小鼠随机分为对照组和模型组,每组 5 只。模型组于第 1、3、5、7、9、11、13、15、17、19 天腹腔注射 3 mg/kg奥沙利铂,第 7、14 天给予 3.0 Gy X射线照射;对照组于相同时间点腹腔注射等剂量生理盐水,经铅砖遮挡进行假照射。观察小鼠一般状态及身体质量,第 20 天进行血液检查、脾脏指数及脾、骨髓病理检查。结果 与对照组相比,模型组小鼠在第 1 次X射线照射后,出现精神萎靡;第 2 次X射线照射后,毛色无光泽,耳、四肢逐渐苍白,身体质量增长速度明显下降;脾体积减小、脾脏指数降低 (P<0.001);外周血白细胞、红细胞、血红蛋白、血小板水平显著下降(P<0.001 或 0.01);HE染色显示脾组织结构疏松,骨髓有核细胞减少,存在大量脂肪空泡。结论 奥沙利铂联合X射线可建立再生障碍性贫血小鼠模型。
Abstract
Objective To establish a mouse model of aplastic anemia using oxaliplatin and X-ray irradiation. Methods Ten mice were randomly divided into control group (n=5) and model group (n=5). The model group were intraperitoneally injected with 3 mg/kg oxaliplatin at 1, 3, 5, 7, 9, 11, 13, 15, 17, and 19 days, and radiated with 3.0 Gy X-ray at 7 and 14 days; while the control group received intraperitoneal injection of the same dose of normal saline and sham irradiation with lead brick shielding at the same timepoints. The general condition and body weight of mice were observed. On the 20th day, blood examination, spleen index and pathological examination of spleen and bone marrow were performed. Results Compared with control group, model group showed listlessness after the first X-ray irradiation; dull fur color, gradual paleness of ears and limbs, and decreased weight growth rate after the second X-ray irradiation. The spleen volume and index decreased (P<0.001). White blood cells, red blood cells, hemoglobins, and platelets of peripheral blood reduced dramatically (P<0.001 or 0.01). Hematoxylin-eosin (HE) stain revealed loose structure of spleen and decreased nucleated cells with numerous fat vacuoles of bone marrow. Conclusion Combined oxaliplatin and X-ray irradiation can create an aplastic anemia model in mice.
Keywords
再生障碍性贫血(aplastic anemia,AA)是以造血干细胞流失、骨髓抑制和血细胞生产不足为主要特征的骨髓造血功能衰竭性疾病[1]。研究表明,我国AA的发病率为 7.4/100 万,是欧洲与北美的 2~3 倍,且症状更为复杂[2-4]。目前,AA的发病机制尚未明了,发病率又逐年升高,对患者的生活质量造成极大威胁[5-6]。因此,构建与人类AA发病症状相似且稳定、可靠的AA 动物模型,对研究AA的发病机制及新药治疗具有重大意义。现阶段,构建AA动物模型的方法众多,但各有优势与不足[7-8]。本文通过探讨构建AA动物模型的新方法,旨在为后续AA的相关研究提供一种理想的实验模型。
1 材料和方法
1.1 材料
1.1.1 实验动物
无特定病原体(SPF)级雄性昆明 (KM)小鼠 10 只,身体质量为 25~30 g,8 周龄,由长沙市天勤生物技术有限公司 [SCXK(湘)2019-0014] 提供。动物饲养于广东医科大学实验动物中心[SYXK (粤)2019-0213],温度为 20~26℃,湿度为 30%~70%, 12 h/12 h 明暗交替,自由饮食和饮水。实验方案通过广东医科大学实验动物伦理委员会批准(编号 GDY2304016)。
1.1.2 主要试剂与仪器
奥沙利铂(上海麦克林生化科技股份有限公司,批号C15936808),X射线辐照仪(Rad Source Technologies,RS2000pro),全自动血液分析仪(深圳迈瑞动物医疗科技股份有限公司, BC-75R-Vet)。
1.2 方法
1.2.1 实验分组与AA模型的建立
KM小鼠适应性喂养 1 周,按随机数字表法将其分为对照组和模型组,每组 5 只。于第 1、3、5、7、9、11、13、15、17、19 天模型组腹腔注射 3 mg/kg的奥沙利铂,对照组腹腔注射同等剂量生理盐水;第 7、14 天模型组给予 3.0 Gy X 射线照射,对照组经铅砖遮挡实行假照射。观察给药期间两组小鼠状态、体型、毛发状况、耳朵与脚爪颜色等变化,并定期测量小鼠的身体质量,第 20 天采血、解剖与取材。
1.2.2 外周血细胞检测
第 20 天采取眼眶后静脉丛取血的方法收集 0.1~0.2 mL全血于抗凝 1.5 mL EP管中并做好标记,使用全自动血液分析仪检测外周血细胞中白细胞(WBC)、红细胞(RBC)、血红蛋白(HGB) 和血小板(PLT)参数。
1.2.3 测量脾脏指数
第 20 天解剖并收集小鼠脾脏,观察脾脏色泽、质地与大小改变,称量并计算脾脏指数 (脾脏指数=脾脏质量/身体质量)。
1.2.4 病理学检测
留取小鼠脾脏与左侧股骨进行组织固定,用石蜡包埋切片,HE染色后观察小鼠脾脏、股骨的组织形态及结构变化。
1.2.5 AA模型成功的判定标准
外周血三系细胞明显减少,且骨髓切片显示骨髓增生低下,非造血细胞如脂肪细胞增多,可判定为AA模型[9]。
1.3 统计学处理
使用统计学软件 SPSS 25.0 及 GraphPad Prism 5.0,计量资料符合正态分布,以表示,采用独立样本t检验与校正t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组小鼠生长状况的比较
对照组小鼠活动正常,精神良好,毛发有光泽,身体质量随时间的推移明显增加;模型组小鼠于第 1 次 X射线照射后活动减弱,精神萎靡,第 2 次X射线照射后开始脱毛,毛色无光泽,耳朵、四肢逐渐苍白,身体质量增长速度明显下降,如图1和图2所示。采样前模型组小鼠死亡 1 只。

图1采样前对照组(左)与模型组(右)小鼠生长状况的比较
2.2 两组小鼠外周血细胞的检测结果
模型组小鼠的 WBC、RBC、HGB 和 PLT 明显低于对照组(P<0.001 或 0.01),见表1。
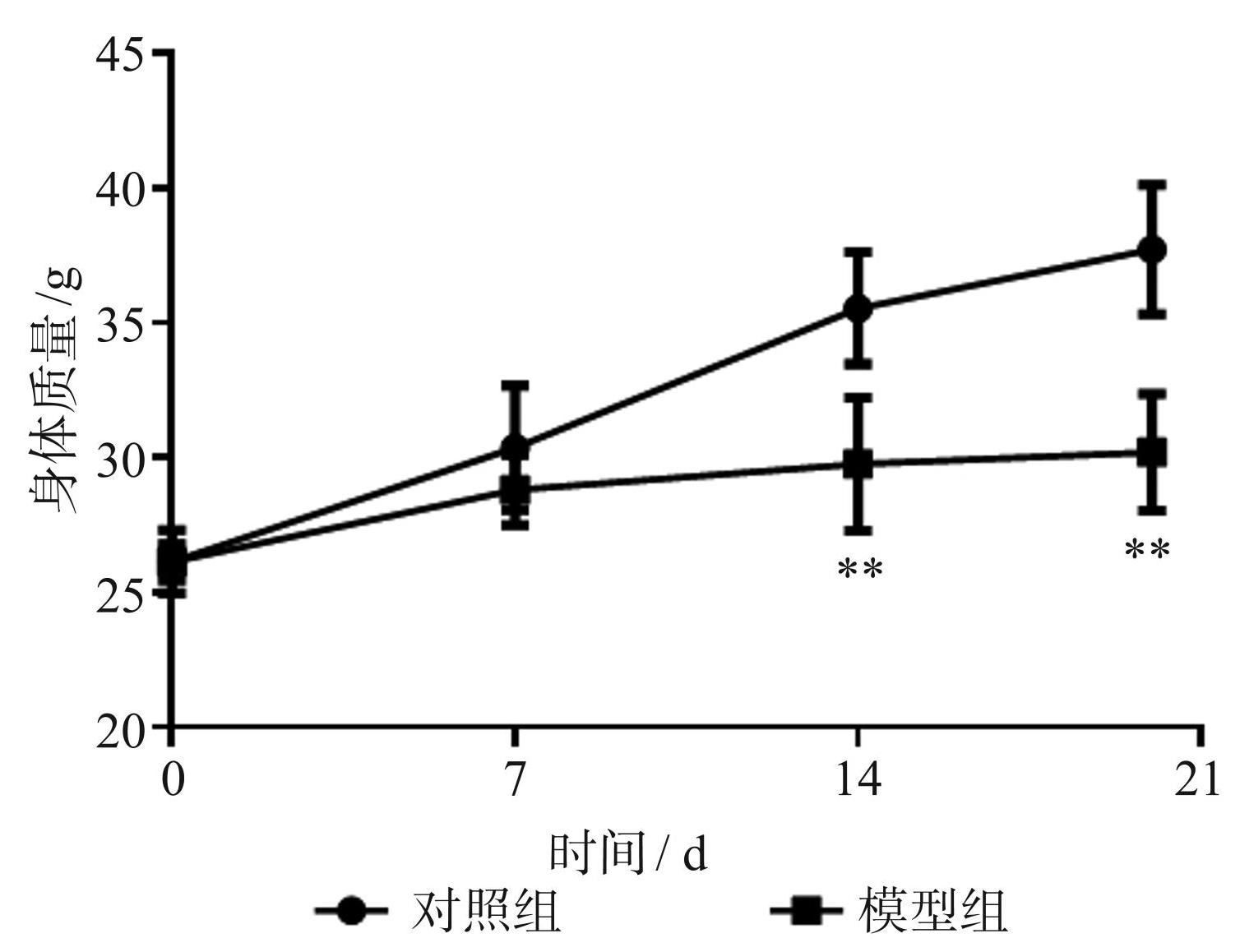
图2两组小鼠身体质量的变化情况(**P<0.01)
2.3 两组小鼠脾脏指数的比较
对照组小鼠脾脏大小与颜色均正常,模型组小鼠脾脏体积明显减小,质量减轻,见图3。两组小鼠脾脏指数如图4所示,模型组小鼠的脾脏指数明显低于对照组小鼠(P<0.001)。
2.4 小鼠脾脏组织结构发生变化
两组小鼠脾脏层次结构清晰,可见被膜、红髓、白髓。其中对照组脾脏组织结构致密,可见清晰的脾小体、中央动脉周围淋巴鞘等白髓结构;模型组脾脏组织结构相对疏松,脾小体萎缩。见图5。
2.5 小鼠骨髓组织结构发生改变
对照组小鼠股骨骨髓腔内组织结构完整,造血细胞分布均匀,未见明显脂肪细胞;模型组小鼠骨髓有核细胞显著减少,存在大量的脂肪空泡,见图6。
3 讨论
AA作为一种常见的血液系统疾病,病因、病机复杂,甚至部分AA患者很难完全治愈,病死率较高[10-13]。因此,研究一种与人类AA发病症状相似的动物模型显得尤为重要[14]。目前,关于制作AA动物模型的方法有很多,经典的造模方法有 3 种,单纯物理或化学方法造模、物理免疫方法造模和物理化学方法造模,各有优势和不足[7-8]。单纯物理方法,即通过γ射线、X射线等对小鼠进行全身照射。此方法采用的射线照射剂量较难把控,照射剂量过大时,会对动物造成全身器官损伤,将导致动物死亡率过高;而照射剂量太小时,动物的造血功能易恢复[15]。单纯化学方法通常通过腹腔注射化学药物进行造模,常用药物包括苯剂、环磷酰胺、氯霉素等[16]。此方法造模成本较低,操作简单,但周期较长,存在模型建立不稳定、应用限制较多等缺点[17]。物理免疫方法,即实验动物经γ射线或X射线照射后, 4 h后注射异种淋巴细胞混悬液。此方法制作周期短,但操作复杂,存在一定难度[18]。物理化学方法造模是目前较新颖的造模方式[19],本研究中所使用的造模方法就属于物理化学方法的一种。小鼠腹腔注射化疗药物奥沙利铂,剂量为 3 mg/kg,隔天注射,然后每周给予小鼠 3.0 Gy X射线照射,持续 20 d,造模结果显示 AA动物模型的症状符合AA的临床特征。这种方法综合了前述几种方法的优点,操作简单,有利于后续相关治疗药物疗效研究与机制的探索。
表1两组小鼠外周血细胞检测结果的比较

与对照组比较:a P<0.01,b P<0.001
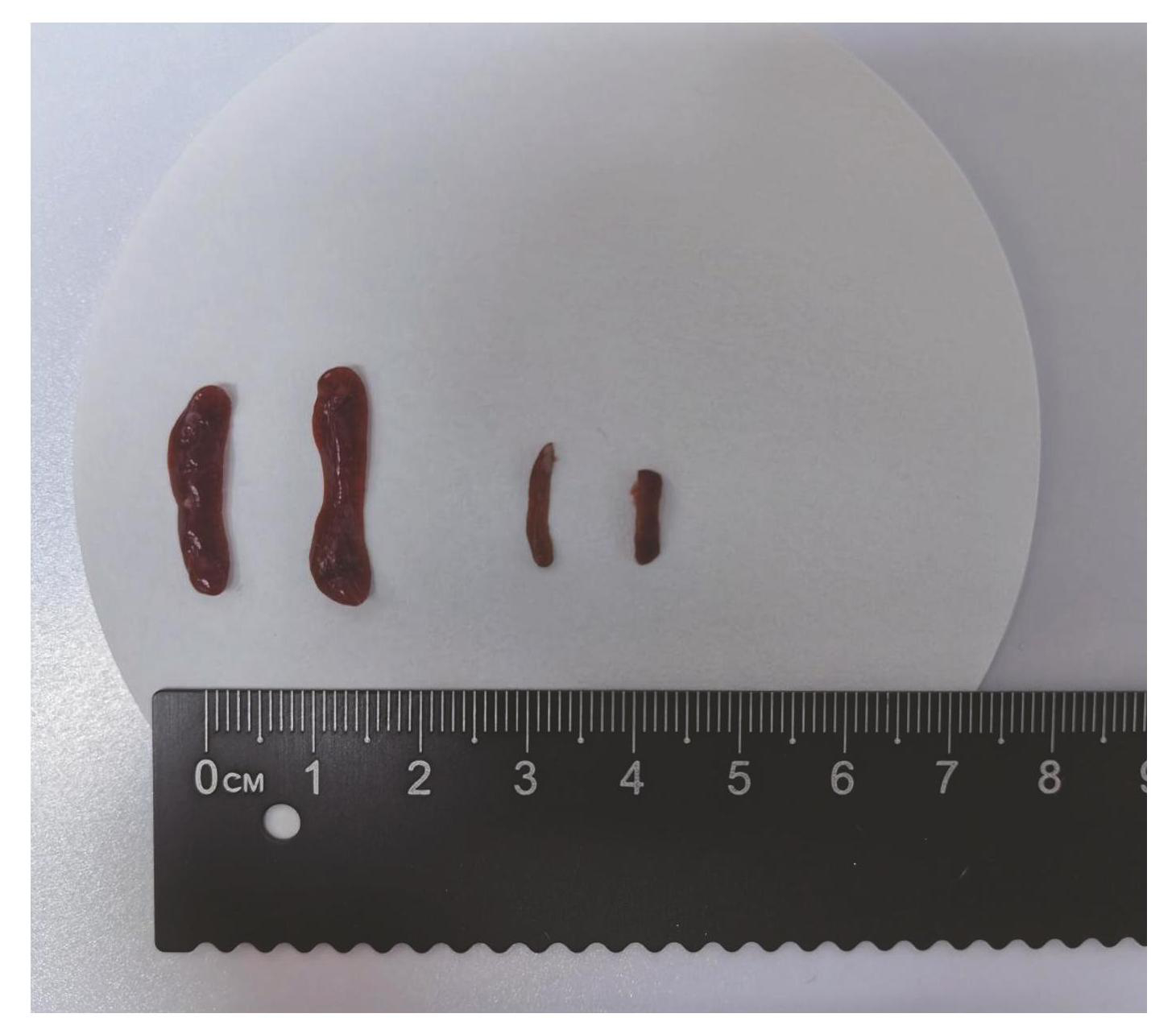
图3对照组(左侧 2 个)与模型组小鼠(右侧 2 个)脾脏对比结果
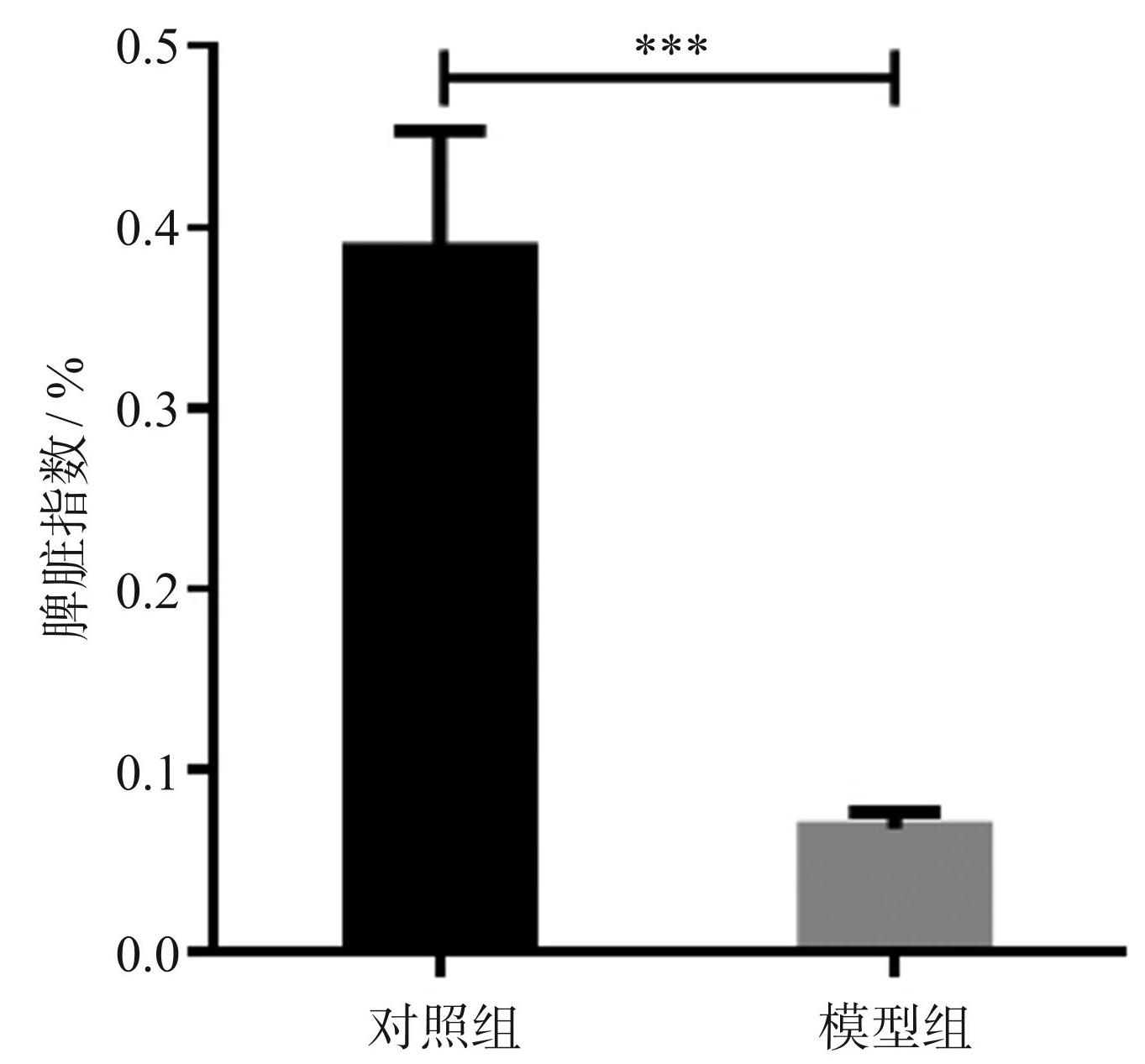
图4两组小鼠脾脏指数的比较(***P<0.001)
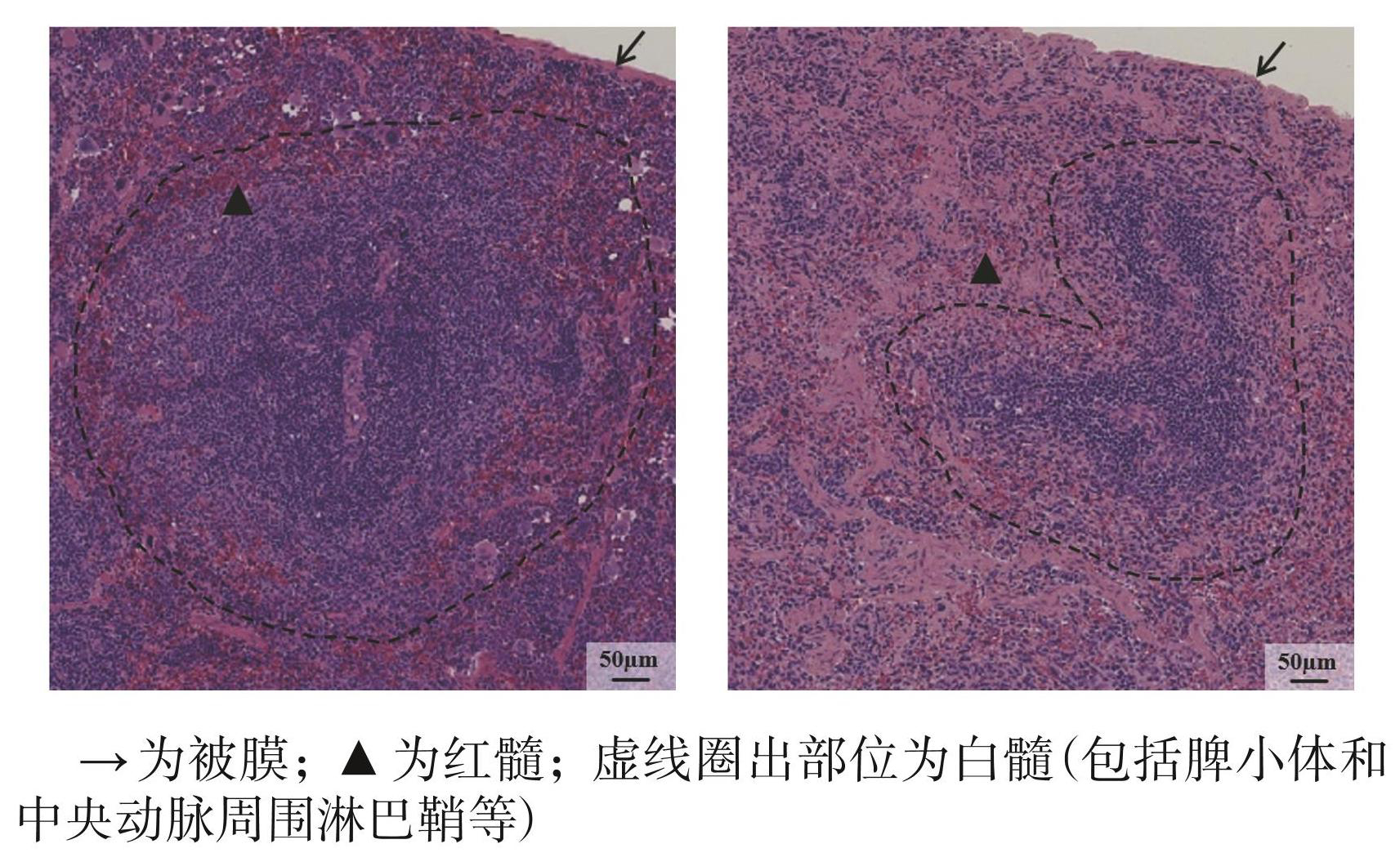
图5对照组(左)与模型组(右)脾脏组织切片(HE染色,40×)

图6对照组(左)与模型组(右)股髓组织切片(HE染色,40×)
本研究发现,采用单纯注射奥沙利铂或单纯使用 X射线照射进行造模时,造模周期较长且模型建立不稳定。预实验中,我们给予小鼠 2.0、3.0、4.0 和 5.0 Gy X射线的照射,发现使用 2.0 Gy X射线照射的小鼠基本无明显变化,3.0 Gy X射线照射的小鼠在第 18 天出现脱毛。小鼠在第 1 次 4.0 和 5.0 Gy X射线照射后精神萎靡,2~3 d出现脱毛,毛色无光泽;第 2 次 5.0 Gy X射线照射后出现部分死亡。另外,小鼠在腹腔注射奥沙利铂进行造模时,血液分析小鼠外周血 WBC、 RBC、HGB和PLT水平下降。后续实验将通过调整X 射线的剂量以及奥沙利铂的浓度控制AA病情的严重程度,也可通过调整造模周期进而调整患病程度,进一步影响动物的存活时间,为研究不同病程进展情况下的AA治疗方案提供相适应的动物模型。






